Расчеты по уравнениям реакций
Пример 1
Какой объем водорода, измеренный при нормальных условиях, выделится при взаимодействии 48,75 г цинка с избытком соляной кислоты?
Решение
а) Записываем уравнение реакции:
Zn + 2HCl ZnCl2 + H2.
б) Определяем химическое количество вещества цинка:
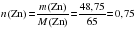 моль.
моль.
Из уравнения реакции следует, что при растворении цинка химическим количеством 1 моль образуется 1 моль водорода. Следовательно,
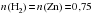 моль.
моль.
в) Определяем объем выделившегося водорода при нормальных условиях:
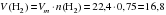 л.
л.
Ответ: 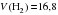 л.
л.
Пример 2
К раствору, содержащему хлорид бария массой 104 г, прилили раствор, содержащий сульфат натрия массой 92,3 г. Определите массу образовавшегося осадка и массы веществ, оставшихся в растворе.
Решение
а) Записываем уравнение реакции:
BaCl2 + Na2SO4 BaSO4 + 2NaCl.
б) Определяем химическое количество вещества хлорида бария и сульфата натрия:
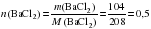 моль;
моль;
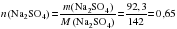 моль.
моль.
в) Определяем, какое из веществ взято в избытке.
Из уравнения реакции следует, что для реакции с хлоридом бария химическим количеством 1 моль требуется 1 моль сульфата натрия.
Следовательно,
1 моль BaCl2 взаимодействует с 1 моль Na2SO4
0,5 моль BaCl2 взаимодействует с x моль Na2SO4.
Отсюда,
x = 0,5 моль.
0,5 моль – химическое количество вещества сульфата натрия, которое потребуется для реакции. Рассчитанное химическое количество меньше, чем количество Na2SO4, которое было взято для реакции (0,65 моль), следовательно, Na2SO4 взят в избытке. Расчет химического количества вещества (массы, объема) продукта необходимо проводить, используя химическое количество (массу, объем) вещества, взятого в недостатке, то есть хлорида бария.
г) Определим массу образовавшегося осадка.
Из уравнения реакции следует:
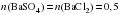 моль.
моль.
Тогда,
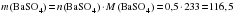 г.
г.
д) Определим массы веществ в растворе.
После завершения реакции в растворе остались хлорид натрия и сульфат натрия. Хлорид бария полностью прореагировал, а сульфат бария выпал в осадок.
Из уравнения реакции следует:
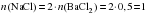 моль.
моль.
Химическое количество прореагировавшего Na2SO4 – nпр.(Na2SO4)=0,5 моль. Химическое количество исходного Na2SO4 – nисх.(Na2SO4)=0,65 моль. Следовательно, химическое количество сульфата натрия, оставшегося в растворе:
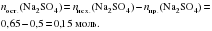
Тогда,
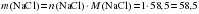 г;
г;
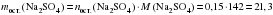 г.
г.
Ответ: m(BaSO4)=116,5 г; m(NaCl)=58,5 г; mост.(Na2SO4)=21,3 г.
Пример 3
К раствору, содержащему фосфат натрия массой 4,92 г, прилили избыток раствора хлорида кальция. Определите массу полученного осадка, если массовая доля выхода продукта реакции составила 86 %.
Решение
а) Записываем уравнение реакции:
2Na3PO4 + 3CaCl2 Ca3(PO4)2 + 6NaCl.
б) Найдем массу Ca3(PO4)2 для случая, когда массовая доля выхода продукта реакции равна 100 %. Для этого определяем химическое количество фосфата натрия:
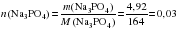 моль.
моль.
Из уравнения реакции следует:
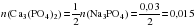 моль.
моль.
Для определения химического количества фосфата кальция удобно над формулами веществ в уравнении реакции записать их химические количества, а под – коэффициенты:
0,03 моль x моль
2Na3PO4 + 3CaCl2 Ca3(PO4)2 + 6NaCl.
2 моль 1 моль
Тогда химическое количество Ca3(PO4)2 легко найти из пропорции:
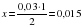 моль.
моль.
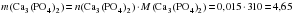 г.
г.
Поскольку массовая доля выхода продукта реакции в реальном процессе составила 86 %, то масса осадка, полученная на практике (mпр), будет меньше, чем масса, рассчитанная по уравнению реакции:
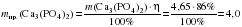 г.
г.
Ответ: 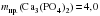 г.
г.


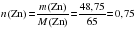 моль.
моль.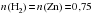 моль.
моль.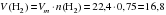 л.
л.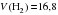 л.
л.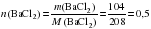 моль;
моль;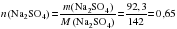 моль.
моль.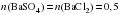 моль.
моль.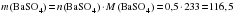 г.
г.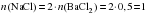 моль.
моль.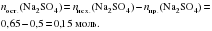
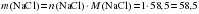 г;
г;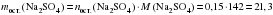 г.
г.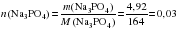 моль.
моль.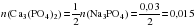 моль.
моль.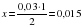 моль.
моль.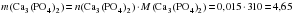 г.
г.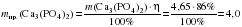 г.
г.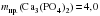 г.
г.