Раствор – однородная система, состав которой может в определенных пределах непрерывно изменяться, а свойства отличаются от свойств исходных компонентов.
По существу растворы – это однородные смеси.
Компонентами растворов являются растворенное вещество и растворитель.
Растворителем считается то вещество, свойства которого (в первую очередь, агрегатное состояние) преобладают. Например, раствор поваренной соли в воде: система является жидкой, поэтому мы называем ее водным раствором хлорида натрия. Масса растворителя, как правило, больше, чем масса растворенного вещества. В школьном курсе химии рассматриваются только жидкие растворы, в которых растворителем является вода. Тем не менее, существуют твердые растворы, примерами их могут служить сплавы металлов. Растворителями могут быть и другие жидкости, например, спирты и углеводороды.
Растворенные вещества могут быть твердыми, жидкими и газообразными. Раствор может содержать как одно, так и несколько растворенных веществ.
При растворении веществ происходит распределение частиц растворенного вещества между молекулами растворителя. На первый взгляд, может показаться, что это чисто физический процесс, подобный смешиванию песка и сахара. На самом деле все гораздо сложнее, об этом свидетельствуют тепловые эффекты, сопровождающие процессы растворения.
Например, при смешивании серной кислоты и воды наблюдается такое сильное разогревание, которое может привести к закипанию и разбрызгиванию образовавшегося раствора. Поэтому, во избежание сильного разогрева системы необходимо вливать небольшими порциями серную кислоту в воду!
Растворение может сопровождаться охлаждением. Например, если растворять некоторые соли в стакане, стоящем на мокрой поверхности, охлаждение будет таким сильным, что стакан примерзнет. Так ведут себя хлорид кальция, нитрат аммония и ряд других солей.
Массовая доля растворенного вещества, выраженная в граммах, равна числу граммов растворенного вещества в 100 граммах раствора.
На практике массовая доля растворенного вещества рассчитывается как отношение массы растворенного вещества к массе раствора. В этом случае она может иметь значения от нуля до единицы:
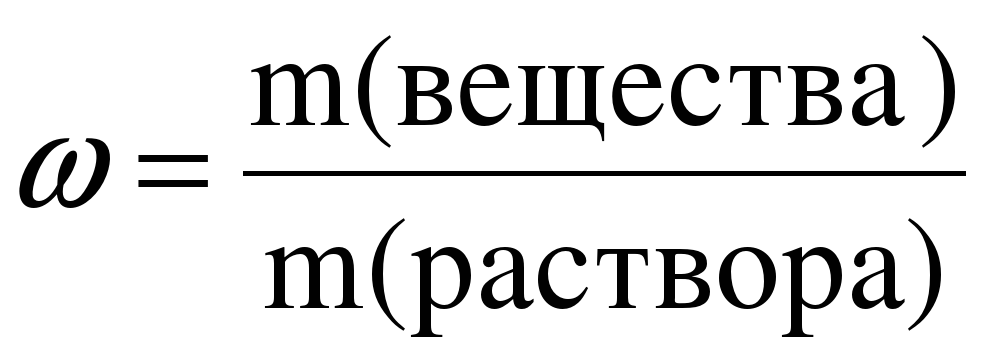
.
П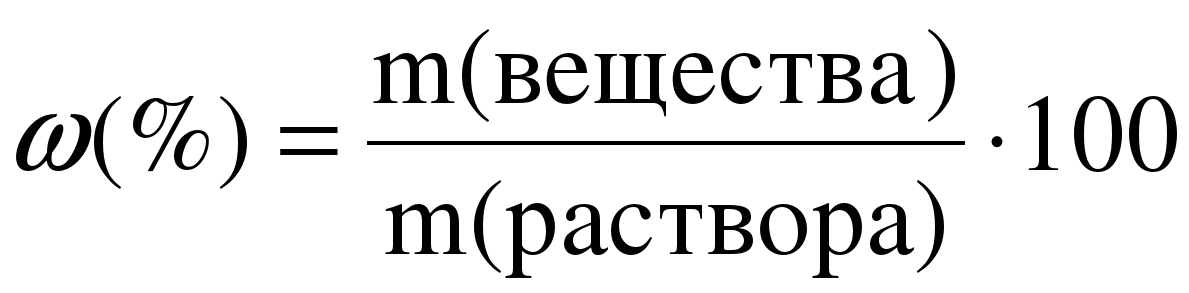 ри выражении массовой доли в процентах, она может принимать значения от нуля до ста:
ри выражении массовой доли в процентах, она может принимать значения от нуля до ста:
.

Пример 1. Рассчитайте массы медного купороса и воды, необходимые для приготовления 500 г 10 % раствора CuSO4.
Раствор должен содержать 10 г CuSO4 в 100 г раствора. В нашем случае масса раствора составляет 500 г, следовательно, масса CuSO4 равна 50 г. Теперь рассчитаем, какой массе медного купороса CuSO45Н2О соответствуют 50 г безводного сульфата меди:
M(CuSO4) = 160 г/моль;
n(CuSO4) = 50/160 = 0,313 моль;
M(CuSO45Н2О) = 250 г/моль;
m(CuSO45Н2О) = 250 0,313 = 78,3 г.
Рассчитаем массу воды, которая будет равна разности между массой раствора (500 г) и массой взятого медного купороса:
m(Н2О) = 500 – 78,3 = 421,7 г.
Пример 2. Чему равна массовая доля NaCl в насыщенном при 20 оС растворе поваренной соли?
Растворимость NaCl при указанной температуре составляет 35,9 г на 100 г воды. Общая масса насыщенного раствора будет равна сумме масс соли и воды, то есть 135,9 г. Тогда массовая доля NaCl равна:
(нас.NaCl) = 35,9/135,9 = 0,264 или 26,4 %.
В зависимости от величины массовой доли растворенного вещества различают концентрированные и разбавленные растворы. Четкой границы между этими понятиями нет. Обычно принято считать, что растворы с массовой долей более 10 % являются концентрированными, менее 10 % – разбавленными. Хотя для веществ с низкой растворимостью и 10 % раствор может считаться концентрированным. Добавлением растворителя можно из концентрированного раствора получить разбавленный. Испарением растворителя, наоборот, из разбавленного раствора – концентрированный.
Помимо массовой доли растворенного вещества, существуют и другие способы выражения состава растворов. Наряду с массовой долей, широко используется молярная концентрация. Подробно о молярной концентрации говорилось в § 25. Напомним, что это такое.
Молярная концентрация – число моль растворенного вещества, содержащееся в одном дм3 (1000 см3 или 1 л) раствора.
Молярная концентрация обозначается латинской буквой с, размерность – моль/дм3 или моль/л. Ее также обозначают буквой М.
Молярная концентрация равна отношению количества растворенного вещества (в моль) к объему раствора (в дм3 или литрах). Молярная концентрация рассчитывается по формуле:
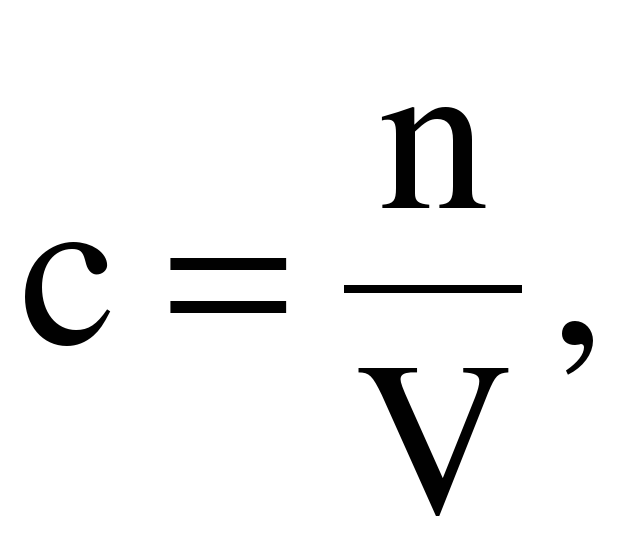
где: n – число моль растворенного вещества,
V – объем раствора, дм3.

Пример. Раствор, содержащий в одном литре 0,01 моль хлорида натрия можно назвать следующими способами: 0,01 М раствор NaCl; либо раствор с концентрацией NaCl 0,01 моль/л; либо 0,01 молярный раствор NaCl.
Поскольку массовая доля измеряется относительно массы раствора, а молярная концентрация – относительно его объема, при переходе от одного способа выражения состава раствора к другому, необходимо знать плотность данного раствора.
П ример. Рассчитайте молярную концентрацию 20 % раствора NaOH плотностью 1,22 г/см3.
ример. Рассчитайте молярную концентрацию 20 % раствора NaOH плотностью 1,22 г/см3.
Из условия задачи следует, что 100 г раствора содержат 20 г NaOH, то есть 0,5 моль гидроксида натрия.
Найдем, какой объем занимают 100 г данного раствора:
V = m/ = 100/1,22 = 82,0 см3 или 0,082 дм3.
Найдем молярную концентрацию NaOH:
с = n/V = 0,5/0,082 = 6,1 моль/дм3 или 6,1 моль/л.
При помощи молярной концентрации состав растворов и других смесей обычно выражают в физической химии. Так, при рассмотрении скоростей химических реакций и химического равновесия концентрации реагирующих веществ приводятся в моль/л. Кроме этого, растворы, содержащие равное число моль реагирующих компонентов, можно брать для данной реакции в равных или кратных объемах. На этом основано использование растворов с определенной молярной концентрацией в аналитической химии.
Пример. Для полной нейтрализации 100 см3 0,1 М раствора NaOH потребуется такой же объем 0,1 М соляной кислоты; либо 50 см3 0,1 М серной кислоты, либо 100 см3 0,05 М Н2SO4.




 ример. Рассчитайте молярную концентрацию 20 % раствора
ример. Рассчитайте молярную концентрацию 20 % раствора