Газообразное состояние вещества. Закон Авогадро. Молярный объём газа.
Вещества могут находиться в трех агрегатных состояниях – твердом, жидком и газообразном. Частицы, из которых состоят твердые вещества, достаточно прочно связаны между собой, поэтому твердые вещества имеют определенную форму. Частицами твердых тел могут быть атомы, молекулы, ионы, образующие кристаллические структуры. Эти частицы колеблются с небольшой амплитудой около узлов кристаллической решетки. В жидкостях частицы связаны друг с другом слабее и могут передвигаться на довольно большие расстояния. Поэтому жидкости обладают текучестью и приобретают форму сосуда, в котором они находятся.
Переход вещества из твердого состояния в жидкое происходит при нагревании, в результате которого амплитуда колебаний частиц постепенно возрастает. При некоторой температуре частицы вещества приобретают способность покидать узлы решетки, происходит плавление. При охлаждении, наоборот, частицы жидкости теряют способность перемещаться и фиксируются в определенном положении, образуя твердое вещество. При обычных условиях жидкости, как правило, имеют молекулярное строение. При высокой температуре структура жидкости может быть и другой (расплавы солей и металлов).
Взаимодействие между молекулами гораздо слабее, чем между ионами в ионных кристаллических структурах; атомами, связанными ковалентной связью в атомных структурах; ионами металлов, связанными электронным газом в металлических структурах.
Твердое и жидкое состояния вещества имеют общее название конденсированное состояние. Плотности веществ в конденсированном состоянии находятся в пределах примерно 0,5 – 22,5 г/см3. Вещества в газообразном состоянии имеют значительно меньшие плотности – порядка 10–2 – 10–3 г/см3. Переход в газообразное состояние осуществляется в результате нагревания веществ, находящихся в конденсированном состоянии (кипение жидкостей, возгонка твердых веществ). Газообразные при обычных условиях вещества состоят из молекул.
При переходе в газообразное состояние частицы вещества преодолевают силы межмолекулярного взаимодействия. Объем, который занимает газ, это, по существу, объем свободного пространства между хаотически движущимися молекулами газа. Величина этого пространства определяется температурой и давлением. При этом объемом, занимаемым самими молекулами, можно пренебречь. Отсюда следует закон Авогадро:

В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул.
Из закона Авогадро вытекают два основных следствия.
Первое следствие
Один моль любого газа при одинаковых условиях занимает одинаковый объем. Этот объем называется молярным объемом газа (Vm), который измеряется в м3/моль (чаще в дм3/моль). Молярный объем газа равен отношению объема газа к его количеству:
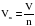 .
.
Понятно, что величина Vm зависит от условий (температура, давление). Для решения задач необходимо запомнить величину Vm при нормальных условиях (н.у.) – атмосферном давлении (101,3 кПа) и температуре таяния льда (0 0С или 273,15 K).

При нормальных условиях Vm = 22,4 дм3/моль, или
в единицах СИ 0,0224 м3/моль.
Второе следствие
Плотности газов (либо массы их одинаковых объемов) относятся между собой как молярные массы газов.
Это видно из следующих соображений. Пусть имеются две порции различных газов одинакового объема (объемы измерены при одинаковых условиях). Найдем их массы:
Газ 1: 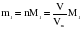 ;
;
Газ 2: 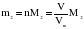 .
.
Отношение их масс:
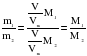 .
.
Если использовать плотности:
Газ 1: 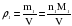 ;
;
Газ 2: 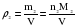 .
.
По закону Авогадро n1=n2, отсюда: 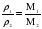
Отношение плотностей газов, равное отношению молярных масс, называется относительной плотностью одного газа по другому (D). D – величина безразмерная.
Зная D и молярную массу одного газа, легко найти молярную массу другого газа:
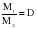 ; M1 = M2 × D.
; M1 = M2 × D.
 Примеры
Примеры
 Относительная плотность газа по водороду равна 8,5. Определите молярную массу газа.
Относительная плотность газа по водороду равна 8,5. Определите молярную массу газа.
М(х) = М(Н2) × D = 2 × 8,5 = 17 г/моль
Газ с такой молярной массой – аммиак NH3.
Плотность некоторого газообразного углеводорода по воздуху равна двум. Определите молярную массу углеводорода.
Средняя молярная масса воздуха равна 29 г/моль.
М(х) = М(возд.) × D = 29 × 2 = 58 г/моль
Углеводород с такой молярной массой – С4Н10, бутан.
Следует отметить, что газы с молярной массой меньше 29 легче воздуха, больше 29 – тяжелее.
В расчетных задачах могут быть даны относительные плотности по азоту, кислороду и другим газам. В этом случае для нахождения молярной массы необходимо умножить относительную плотность на молярную массу соответственно азота (28 г/моль), кислорода (32 г/моль) и т. д.
Закон Авогадро широко применяется в химических расчетах. Поскольку для газов объемы пропорциональны количествам веществ, то коэффициенты в уравнении реакции, отражающие количества реагирующих веществ, пропорциональны объемам взаимодействующих газов. Очевидно, что объемы должны быть измерены при одинаковых условиях.

 Пример
Пример
Какой объем кислорода потребуется для сжигания 2 дм3 пропана? Объемы измерены при н. у.
С3Н8 + 5О2 3СО2 + 4Н2О.
Из закона Авогадро следует, что равные объемы различных газов содержат одинаковое число молекул, и, соответственно, одинаковое число моль веществ. Пусть объем пропана равен 1 дм3. Тогда, из уравнения реакции, для сжигания 1 дм3 пропана потребуется 5 дм3 кислорода, а для 2 дм3 (двух литров) – 10 дм3 О2.



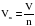 .
.
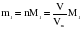 ;
;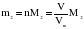 .
.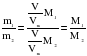 .
.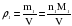 ;
;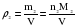 .
.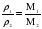
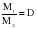
 Примеры
Примеры Относительная плотность газа по водороду равна 8,5. Определите молярную массу газа.
Относительная плотность газа по водороду равна 8,5. Определите молярную массу газа. Пример
Пример