Спирты
Строение
Спиртами (или алканолами) называются органические вещества, молекулы которых содержат одну или несколько гидроксильных групп (групп —ОН), соединенных с углеводородным радикалом.
По числу гидроксильных групп (атомности) спирты делятся на:
• одноатомные
• двухатомные (гликоли)
• трехатомные.
| Одноатомные спирты: | Двухатомный спирт: | Трехатомный спирт: |
| CH3—OH
метанол (метиловый спирт) | CH3CH2—OH
этанол (этиловый спирт) | HO—CH2—CH2—OH
этандиол-1,2 (этиленгликоль) | 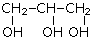
пропантриол-1,2,3 (глицерин)
|
Одноатомные спирты
Общая формула одноатомных спиртов - R—OH.
По типу углеводородного радикала спирты делятся на предельные, непредельные и ароматические.
| Предельный спирт: | Непредельный спирт: | Ароматический спирт: |
| CH3CH2CH2—OH
пропанол-1 (пропиловый спирт) | CH2=CH—CH2—OH
пропенол-2,1 (аллиловый спирт) | C6H5—CH2—OH
фенилметанол (бензиловый спирт) |
Общая формула предельных одноатомных спиртов - CnN2n+1—OH.
Органические вещества, содержащие в молекуле гидроксильные группы, непосредственно связанные с атомами углерода бензольного кольца называются фенолами. Например, C6H5—OH - гидроксобензол (фенол).
По типу атома углерода, с которым связана гидроксильная группа, различают первичные (R—CH2—OH), вторичные (R—CHOH—R') и третичные (RR'R''C—OH) спирты.
| Первичный спирт: | Вторичный спирт: | Третичный спирт: |
| CH3CH2CH2CH2—OH
бутанол-1 (бутиловый сприт) | 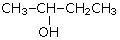
бутанол-2 (втор-бутиловый спирт)
| 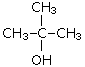
2-метилпропанол-2 (трет-бутиловый спирт)
|
CnN2n+2O - общая формула и предельных одноатомных спиртов, и простых эфиров.
Предельные одноатомные спирты изомерны простым эфирам - соединениям с общей формулой R—O—R'.
Изомеры и гомологи
Для спиртов характерна структурная изомерия (изомерия углеродного скелета, изомерия положения заместителя или гидроксильной группы), а также межклассовая изомерия.
Алгоритм составления названий одноатомных спиртов
Найдите главную углеродную цепь - это самая длинная цепь атомов углерода, с одним из которых связана функциональная группа.
Пронумеруйте атомы углерода в главной цепи, начиная с того конца, к которому ближе функциональная группа.
Назовите соединение по алгоритму для углеводородов.
В конце названия допишите суффикс -ол и укажите номер атома углерода, с которым связана функциональная группа.
Физические свойства спиртов во многом определяются наличием между молекулами этих веществ водородных связей: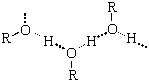
С этим же связана и хорошая растворимость в воде низших спиртов.
Простейшие спирты - жидкости с характерными запахами. С увеличением числа атомов углерода температура кипения возрастает, а растворимость в воде падает. Температура кипения у первичных спиртов больше, чем у вторичных спиртов, а у вторичных - больше, чем у третичных. Метанол крайне ядовит.
Химические свойства спиртов
Горение:
C2H5OH + 3O2 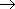 2CO2 +3H2O + Q
2CO2 +3H2O + Q
Реакции с щелочными и щелочноземельными металлами ("кислотные" свойства):
Атомы водорода гидроксильных групп молекул спиртов, также как и атомы водорода в молекулах воды, могут восстанавливаться атомами щелочных и щелочноземельных металлов ("замещаться" на них).
2Na + 2H—O—H 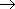 2NaOH + H2
2NaOH + H2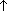
2Na + 2R—O—H 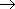 2RONa + H2
2RONa + H2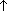
С твердыми щелочами и с их растворами спирты не реагируют.
Реакции с галогеноводородами:
C2H5OH + HBr 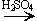 C2H5Br + H2O
C2H5Br + H2O
Внутримолекулярная дегидратация (t 140oС, образуются алкены):
C2H5OH 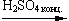 C2H4 + H2O
C2H4 + H2O
Межмолекулярная дегидратация (t oС, образуются простые эфиры):
2C2H5OH 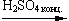 C2H5OC2H5 + H2O
C2H5OC2H5 + H2O
Окисление (мягкое, до альдегидов):
CH3CH2OH + CuO 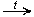 CH3—CHO + Cu + H2O
CH3—CHO + Cu + H2O
Это качественная реакция на спирты: цвет осадка изменяется с черного на розовый, ощущается своеобразный "фруктовый" запах альдегида).
Получение спиртов
Щелочной гидролиз галогеналканов (лабораторный способ): C2H5Cl + NaOH 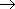 C2H5OH + NaCl.
C2H5OH + NaCl.
Гидратация алкенов: C2H4 + H2O 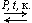 C2H5OH.
C2H5OH.
Брожение глюкозы : C6H12O6 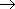 2C2H5OH + 2CO2
2C2H5OH + 2CO2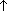 .
.
Синтез метанола: CO + 2H2 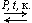 CH3OH
CH3OH
Многоатомные спирты
Существуют и полиатомные (многоатомные) спирты, содержащие более трех гидроксильных групп в молекуле. Например, простейший шестиатомный спирт гексаол (сорбит).
Следует заметить, что спирты, содержащие две гидроксильные группы при одном атоме углерода, неустойчивы и самопроизвольно разлагаются (подвергаются перегруппировке атомов) с образованием альдегидов и кетонов:
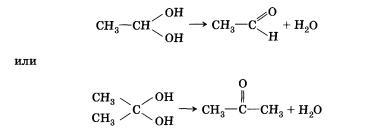
Непредельные спирты, содержащие гидроксильную группу у атома углерода, связанного двойной связью, называются еколами. Нетрудно догадаться, что название этого класса соединений образовано из суффиксов -ен и -ол, указывающих на присутствие в молекулах двойной связи и гидроксильной группы. Енолы, как правило, неустойчивы и самопроизвольно превращаются (изомеризуются) в карбонильные соединения — альдегиды и кетоны. Эта реакция обратима, сам процесс называют кето-енольной таутомерией. Так, простейший енол — виниловый спирт чрезвычайно быстро изомеризуется в уксусный альдегид.
Примерами многоатомных спиртов является двухатомный спирт этандиол (этиленгликоль) HO—CH2—CH2—OH и трехатомный спирт пропантриол-1,2,3 (глицерин) HO—CH2—CH(OH)—CH2—OH.
Это бесцветные сиропообразные жидкости, сладкие на вкус, хорошо растворимы в воде. Этиленгликоль ядовит.

Химические свойства многоатомных спиртов по большей части сходны с химическими свойствами одноатомных спиртов, но кислотные свойства из-за влияния гидроксильных групп друг на друга выражены сильнее.
Качественной реакцией на многоатомные спирты является их реакция с гидроксидом меди(II) в щелочной среде, при этом образуется ярко-синие растворы сложных по строению веществ. Например, для глицерина состав этого соединения выражается формулой Na2[Cu(C3H6O3)2].
Отдельные представители спиртов и их значение
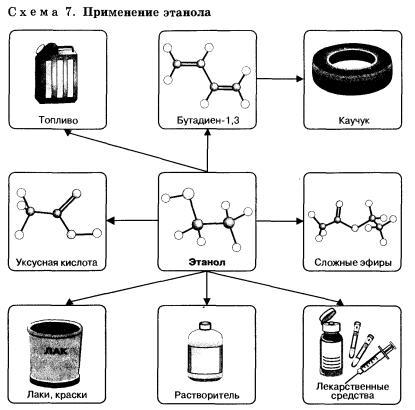
Этанол широко используется в промышленности для производства синтетического каучука, лекарственных препаратов, применяется как растворитель, входит в состав лаков и красок, парфюмерных средств. В медицине этиловый спирт — важнейшее дезинфицирующее средство. Используется для приготовления алкогольных напитков.
Небольшие количества этилового спирта при попадании в организм человека снижают болевую чувствительность и блокируют процессы торможения в коре головного мозга, вызывая состояние опьянения. На этой стадии действия этанола увеличивается водоотделение в клетках и, следовательно, ускоряется мочеобразование, в результате чего происходит обезвоживание организма.
Кроме того, этанол вызывает расширение кровеносных сосудов. Усиление потока крови в кожных капиллярах приводит к покраснению кожи и ощущению теплоты.
В больших количествах этанол угнетает деятельность головного мозга (стадия торможения), вызывает нарушение координации движений. Промежуточный продукт окисления этанола в организме — ацетальдегид — крайне ядовит и вызывает тяжелое отравление.
Систематическое употребление этилового спирта и содержащих его напитков приводит к стойкому снижению продуктивности работы головного мозга, гибели клеток печени и замене их соединительной тканью — циррозу печени.
Фенолы
Фено́лы — органические соединения ароматического ряда, в молекулах которых гидроксильные группы связаны с атомами углерода ароматического кольца.
По числу ОН-групп различают:
одноатомные фенолы (аренолы): фенол (C6H5OH) и его гомологи;
двухатомные фенолы (арендиолы): гидрохинон, пирокатехин, резорцин;
трёхатомные фенолы (арентриолы): пирогаллол, флороглюцин, гидроксигидрохинон и т. д.
Важнейшим представителем фенолов является фенол (гидроксобензол, старые названия - гидроксибензол, оксибензол) C6H5—OH.
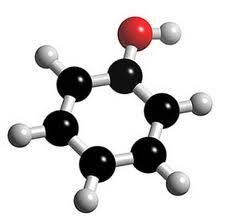 а)
а) 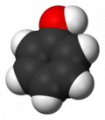 б)
б)
Шаростержневая (а) и масштабная модели молекулы фенола
Изомерия
Возможны 2 типа изомерии:
1. Изомерия положения заместителей в бензольном кольце;
2. Изомерия боковой цепи (строения алкильного радикала и числа радикалов).
В живых организмах
Фенол является окончанием боковой группы стандартной аминокислоты тирозина, и поэтому входит в состав практически каждой белковой молекулы.
Электронное строение
Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа — OH — положительным. Дипольный момент направлен в сторону бензольного кольца.
Как известно, гидроксильная группа -OH является заместителем I рода, то есть она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях. Смещение не поделённой пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи O-H. Таким образом, имеет место взаимное влияние атомов и атомных групп в молекуле фенола. Это взаимное влияние отражается в свойствах фенола.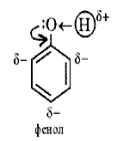
Во-первых, повышается способность к замещению атомов водорода в орто- и пара-положениях бензольного ядра, и в результате реакций замещения обычно образуются три-замещённые производные фенола.
Во-вторых, увеличение полярности связи O-H под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворах по кислотному типу.
Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые являются неэлектролитами.
Физические свойства фенола:
Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол C6H5OH (карболовая кислота) — бесцветное кристаллическое вещество на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °C смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком! 

Химические свойства
Кислотные свойства. Кислотные свойства фенола выражены сильнее, чем у воды и предельных спиртов, что связано с большей полярностью O—H связи и с большей устойчивостью образующегося при ее разрыве фенолят-иона. В отличие от спиртов, фенолы реагируют не только со щелочными и щелочноземельными металлами, но и с растворами щелочей, образуя феноляты:
| 2C6H5OH + 2Na 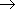 | 2C6H5ONa | + H2 |
|
| фенолят натрия |
|
C6H5OH + NaOH 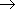 C6H5ONa + H2O
C6H5ONa + H2O
Однако кислотные свойства фенола выражены слабее, чем у карбоновых кислот и, тем более, у сильных неорганических.
Замещение в бензольном кольце. Наличие гидроксильной группы в качестве заместителя в молекуле бензола приводит к перераспределению электронной плотности в сопряженной  -системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
-системе бензольного кольца, при этом увеличивается электронная плотность у 2-го, 4-го и 6-го атомов углерода (орто- и пара-положения) и уменьшается у 3-го и 5-го атомов углерода (мета-положение).
а) Реакция с бромной водой (качественная реакция):
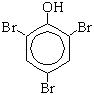
Образуется 2,4,6-трибромфенол - осадок белого цвета.
б) Нитрование (при комнатной температуре):
C6H5—OH + HNO3(разб.) 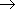 H2O + NO2—C6H4—OH (смесь орто- и пара-изомеров)
H2O + NO2—C6H4—OH (смесь орто- и пара-изомеров)
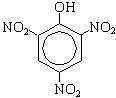
По второй реакции образуется 2,4,6-тринитрофенол (пикриновая кислота).
Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы):
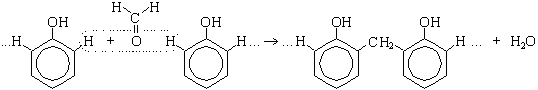
Качественная реакция с хлоридом железа(III). Образуется комплексное соединение фиолетового цвета.
Получение фенола
Современной промышленности известно несколько способов получения фенола:
Кумольный метод получения.
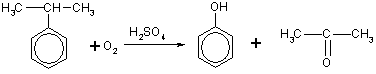
Гидропероксид кумола (ГПК) получают при нормальном (без использования катализаторов) окислении воздухом кумола в каскаде барботажных колонн. А фенол и ацетон получают в ходе разложения ГПК с использованием в качестве катализатора серной кислоты.
Получение фенола путем сплавления ароматических сульфокислот со щелочами.
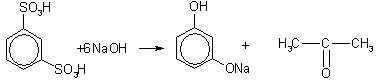
На феноксиды, образованные в результате сплавления ароматических сульфокислот с щелочами, оказывают воздействие сильными кислотами. В результате получаются многоатомные свободные фенолы.
Получение фенола путем воздействия на галогенбензолы:
С6Н5-Сl + 2NaOH C6H5-ONa + NaCl + Н2О
Фенолят натрия получают при взаимодействии гидроксида натрия и хлорбензола. Обязательным катализатором в данной реакции является давление. Далее фенолят натрия обрабатывают кислотой.
Применение фенола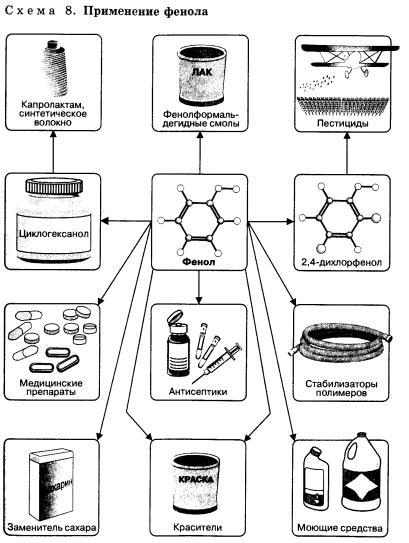
Фенолы применяют в производстве различных феноло-альдегидных смол, полиамидов, полиарилатов, полиариленсульфонов, эпоксидных смол, антиоксидантов, бактерицидов и пестицидов (например, нитрафен). Алкилфенолы используют в производстве ПАВ, стабилизаторов и присадок к топливам. Двухатомные фенолы и их производные входят в состав дубителей для кожи и меха, модификаторов и стабилизаторов резин и каучуков, применяются для обработки кино- и фотоматериалов. В медицине фенолы и их производные используют в качестве антимикробных (фенол, резорцин), противовоспалительных (салол, осарсол), спазмолитических (адреналин, папаверин), жаропонижающих (аспирин, салициловая кислота), слабительных (фенолфталеин), адренолитических (мезатон), вяжущих (таннины) и других лекарственных средств, а также витаминов E и P.







 а)
а)  б)
б)