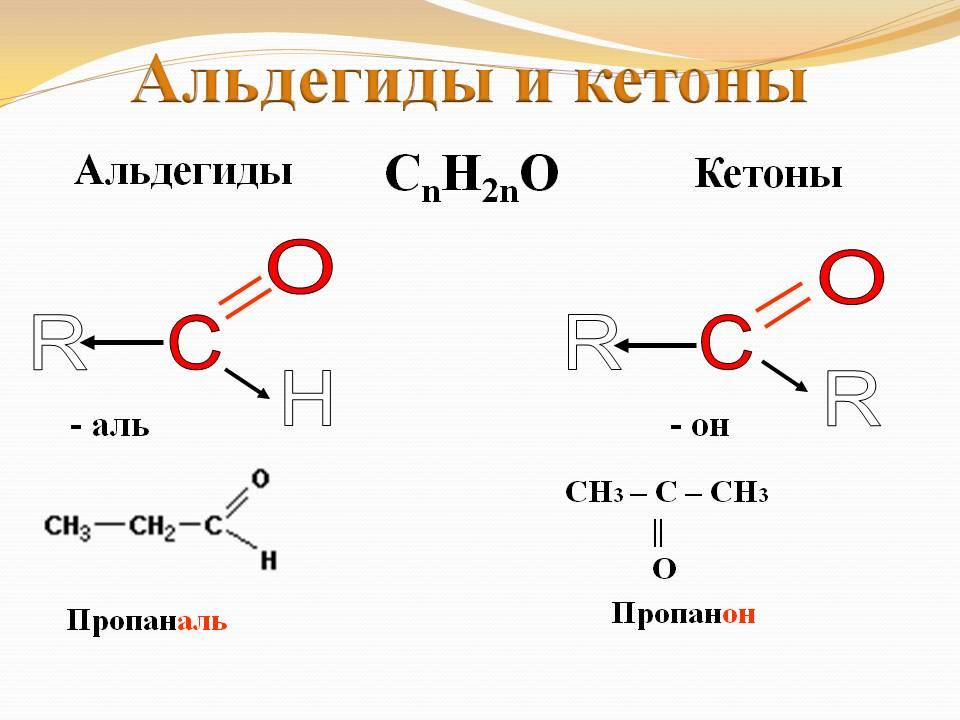
Альдегиды.
На этом занятии будут рассмотрены основные химические свойства альдегидов, получение альдегидов в лаборатории и промышленности. Будут показаны подробные решения расчетных задач и тестов ЕГЭ по заданной теме.
Конспект занятия "Альдегиды."
АЛЬДЕГИДЫ
Альдегиды представляют значительную и важную группу органических соединений, члены которой хотя и не часто встречаются в отдельном состоянии в природе, но без сомнения играют чрезвычайно существенную роль в различных физиологических процессах как животного, так и растительного царства.
Строение
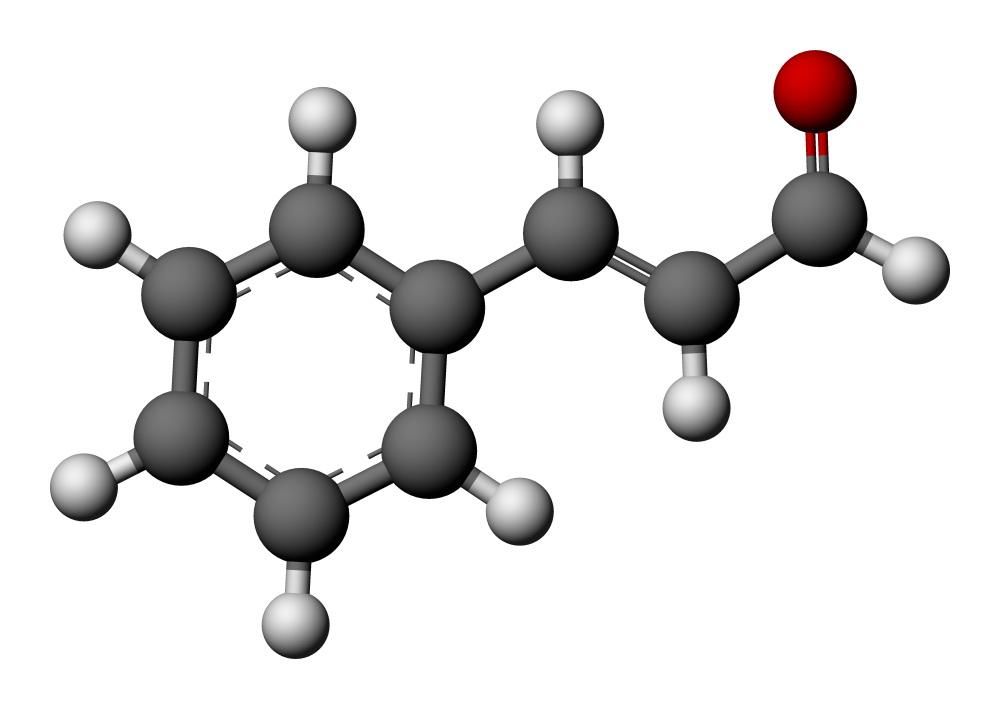
К альдегидам относятся органические соединения, для которых характерна двойная связь между углеродным и кислородным атомами и две одинарные связи этого же атома углерода с углеводородным радикалом, обозначаемым буквой R, и атомом водорода.
Общая формула: R–CН=O
Группа атомов С=О называется карбонильной группой, она характерна для всех альдегидов. Многие альдегиды имеют приятный запах. Они могут быть получены из спиртов путем дегидрирования (удаление водорода), благодаря чему получили общее название — альдегиды. Свойства альдегидов определяются наличием карбонильной группы, ее расположением в молекуле, а также длиной и пространственной разветвленностью углеводородного радикала. То есть, зная название вещества, отражающего его структурную формулу, можно ожидать определенные химические, а также физические свойства альдегидов.
Для альдегидов группа атомов – CHO является функциональной и называется альдегидной.


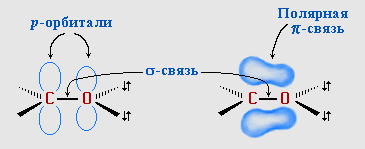
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp2-гибридизации. Углерод своими sp2-гибридными орбиталями образует 3 σ-связи (одна из них – связь С–О), которые располагаются в одной плоскости под углом около 120° друг к другу. Одна из трех sp2-орбиталей кислорода участвует в σ-связи С–О, две другие содержат неподеленные электронные пары.
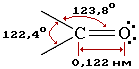
π-Связь образована р-электронами атомов углерода и кислорода.
Связь С=О сильно полярна. Ее дипольный момент (2,6-2,8D) значительно выше, чем у связи С–О в спиртах (0,70D). Электроны кратной связи С=О, в особенности более подвижные π-электроны, смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда. Карбонильный углерод приобретает частичный положительный заряд
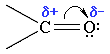
Поэтому углерод подвергается атаке нуклеофильными реагентами, а кислород - электрофильными, в том числе Н+.
Номенклатура
Есть два основных способа именования альдегидов.
Первый метод основан на системе, используемой Международным союзом (IUPAC), его часто называют систематическая номенклатура. Он основывается на том, что самая длинная цепочка, в которой к атому углерода присоединена карбонильная группа, служит основой названия альдегида, то есть его название происходит от названия родственного алкана благодаря замене суффикса –ан на суффикс –аль (метан — матаналь, этан — этаналь, пропан — пропаналь, бутан — бутаналь и так далее). Положение заместителей в главной цепи указывают цифрами, считая карбонильный углерод как С-1.
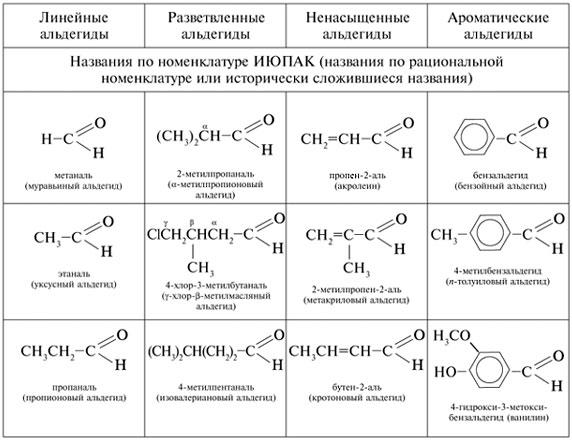
По рациональной номенклатуре названия альдегидов получают из названий соответствующих карбоновых кислот. Альдегиды с боковыми цепями называют как производные соединений с линейной цепью. Положение заместителей указывают греческими буквами ![]() ,
, ![]() ,
, ![]() ,
, ![]() и т. д.;
и т. д.;![]() -углерод – это атом, связанный с группой СНО :
-углерод – это атом, связанный с группой СНО : 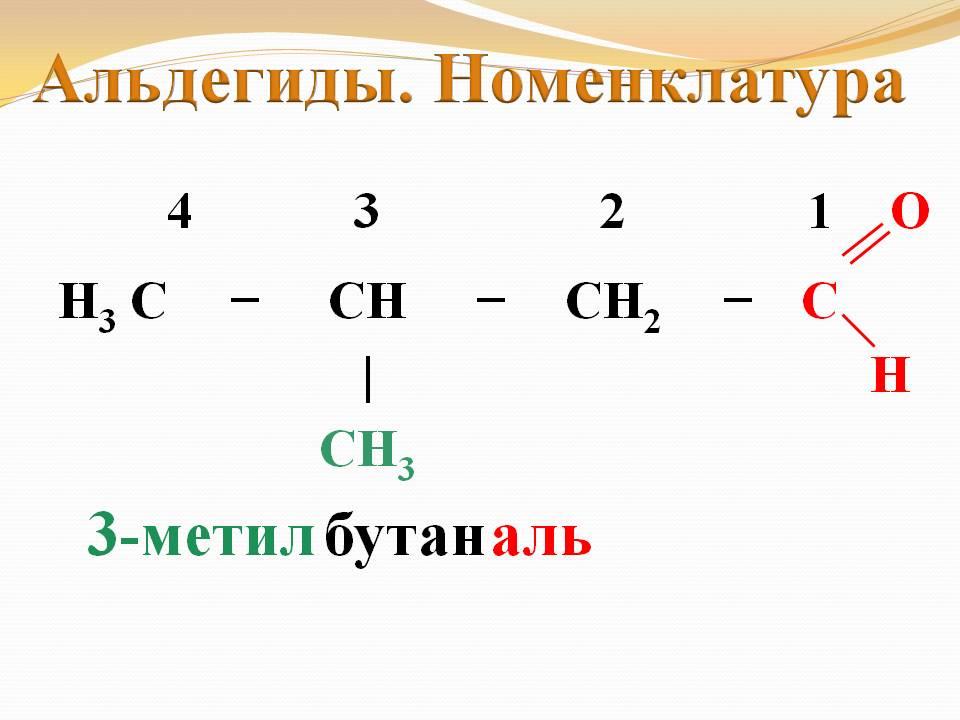
![]()

Некоторые английские названия альдегидов имеют у нас равноправное хождение: формальдегид НСНО, ацетальдегид СН3СНО, бензальдегид С6Н5СНО.
Важнейшие представители альдегидов:
Метаналь, или формальдегид*
Этаналь, или ацетальдегид*
Пропаналь
Бутаналь
2-Метилпропаналь
Пентаналь
Гексаналь
Изомерия
Изомерия альдегидов RCHO состоит в изменении строения углеродного скелета радикала R:
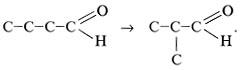
Он может иметь либо неразветвленную, либо разветвленную цепь.
В зависимости от строения углеводородных радикалов альдегиды бывают алифатическими, алициклическими и ароматическими. Изомерия альдегидов связана только со строением радикалов.
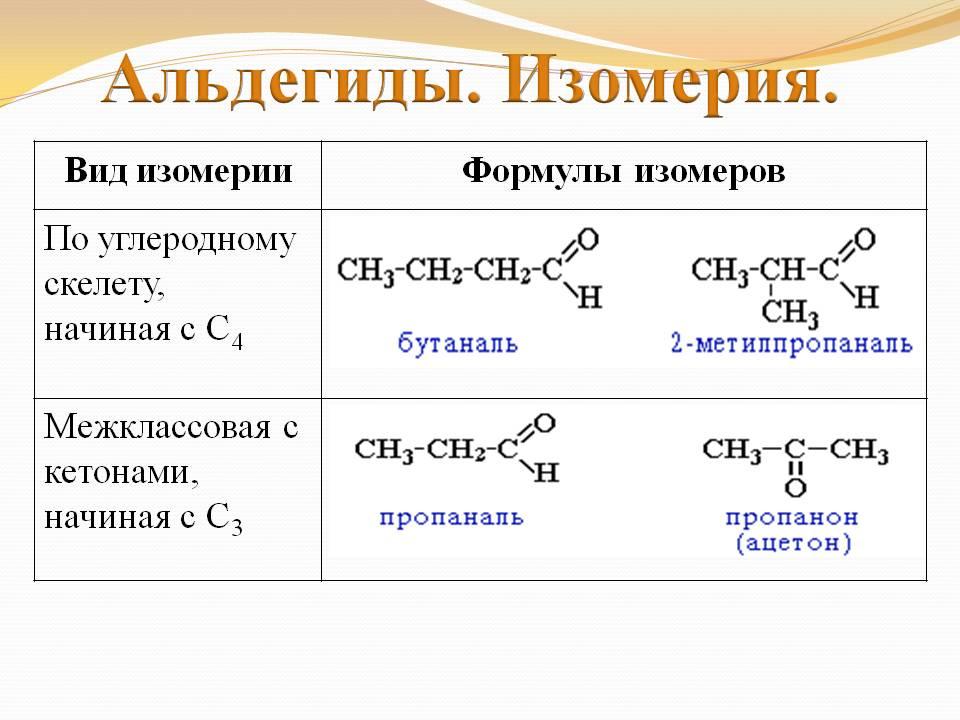 Для альдегидов характерна структурная изомерия:
Для альдегидов характерна структурная изомерия:
изомерия углеродного скелета, начиная с С4
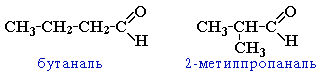
межклассовая изомерия с кетонами, начиная с С3
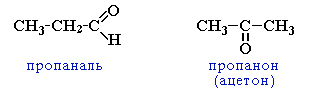
циклическими оксидами (с С2)
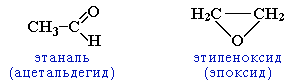
непредельными спиртами и простыми эфирами (с С3)
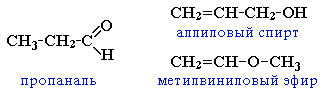
Физические свойства
Наличие карбонильной группы (С=О) определяет физические свойства альдегидов. Именно эта группа отвечает за различия в физических и химических свойствах веществ с одинаковым количеством углеродных атомов или одинаковой молекулярной массой.

Полярность группы С=О влияет на физические свойства альдегидов: температуру плавления, температуру кипения, растворимость, дипольный момент. Углеводородные соединения, состоящие только из атомов водорода и углерода, плавятся и кипят при низких температурах. У веществ с карбонильной группой они значительно выше. Например, бутан (CH3CH2CH2CH3), пропаналь (CH3CH2CHO) и ацетон (CH3СОСН3) имеют одинаковую молекулярную массу, равную 58, а температура кипения у бутана равняется 0 °C, в то время как для пропаналя она составляет 49 °С, а у ацетона равна 56 °C. Причина большой разницы заключается в том, что полярные молекулы имеют больше возможности друг к другу притягиваться, чем неполярные молекулы, поэтому для их разрыва необходимо больше энергии и, следовательно, требуется более высокая температура, чтобы эти соединения плавились или кипели.
С ростом молекулярной массы меняются физические свойства альдегидов. Формальдегид (HCHO) является газообразным веществом при нормальных условиях, ацетальдегид (CH3CHO) кипит при комнатной температуре. Другие альдегиды (за исключением представителей с высоким молекулярным весом) при нормальных условиях являются жидкостями. Полярные молекулы не смешиваются легко с неполярными, потому что полярные молекулы друг к другу притягиваются, и неполярные не в состоянии протиснуться между ними. Поэтому углеводороды не растворяются в воде, так как молекулы воды полярны. Альдегиды, в молекулах которых число атомов углерода менее 5, растворяются в воде, но если число углеродных атомов больше 5, растворение не происходит. Хорошая растворимость альдегидов с низким молекулярным весом обусловлена образованием водородных связей между атомом водорода молекулы воды и атомом кислорода карбонильной группы.
Простейший из альдегидов, муравьиный альдегид — газ, хорошо растворимый в воде, обладающий острым запахом. Низшие альдегиды — жидкости; первые члены ряда смешиваются с водой, а следующие лишь растворимы в ней; высшие альдегиды представляют собой нерастворимые твердые вещества. Низшие альдегиды обладают резким, иногда удушливым запахом.
Физические свойства некоторых альдегидов:
Формальдегид – газ, с резким запахом, раздражает слизистые ткани и оказывает действие на центральную нервную систему. ОПАСЕН ДЛЯ ЗДОРОВЬЯ! Водный раствор формальдегида – формалин.
Ацетальдегид – жидкость , с запахом зелёной листвы. ОЧЕНЬ ТОКСИЧЕН! Подавляет дыхательные процессы в клетках.
Акролеин СН2 = CHCH=O акриловый альдегид, пропеналь (в производстве полимеров) – образуется при пригорании жиров, жидкость с неприятным запахом, раздражает слизистые ткани.
Бензальдегид C6H5CH=O (производство красителей) – жидкость с запахом горького миндаля, содержится в миндале, листьях черёмухи, косточках персиков, абрикосов.
Получение
Окисление спиртов
Окислителем, обычно применяемым для этой цели в лабораториях, является хромовая кислота, употребляемая чаще всего в виде «хромовой смеси» (смесь бихромата калия или натрия с серной кислотой). Иногда применяются также перманганаты различных металлов или перекись марганца и серная кислота. Наиболее важным практическим способом получения альдегидов является окисление спиртов кислородом воздуха в присутствии металлических катализаторов. Такими катализаторами, действующими уже при обыкновенной температуре, могут служить платина и другие металлы группы платины, а при повышенной температуре — металлическая медь.
Дегидрогенизация (дегидрирование) спиртов
При пропускании паров спирта через нагретые трубки с мелко раздробленной, восстановленной водородом металлической медью первичные спирты распадаются на альдегид и водород, а вторичные — на кетон и водород. Несколько хуже эта реакция проходит в присутствии никеля, железа или цинка.
Получение из одноосновных карбоновых кислот
Альдегиды можно получать восстановлением кислот:
![]()
Для этой цели применяют частично отравленную сернистыми соединениями платиновую чернь (восстановление хлорангидридов по Розенмунду).
Кетоны и альдегиды могут быть получены также сухой перегонкой кальциевых и бариевых солей одноосновных кислот. Для всех кислот, кроме муравьиной, реакция идет следующим образом:
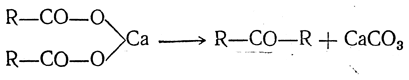
Чаще восстанавливают не самые кислоты, а их производные, например хлорангидриды:
![]()
т. е. образуется кетон с двумя одинаковыми радикалами и карбонат кальция.
Если взять смесь солей двух кислот или смешанную соль, то наряду с предыдущей реакцией происходит также реакция между молекулами разных солей:
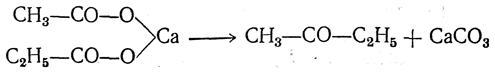
Если же взять смесь солей, из которых одна — соль муравьиной кислоты, то получается альдегид:
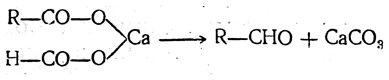
Вместо сухой перегонки готовых солей используют также контактный способ, так называемую реакцию кетонизации кислот, состоящую в том, что пары кислот пропускают при повышенной температуре над катализаторами, в качестве которых применяют углекислые соли кальция или бария, закись марганца, окись тория, окись алюминия и др. Для получения этим путем альдегидов лучшими катализаторами являются закись марганца и окись титана.
Несомненно, здесь сначала образуются соли органических кислот, которые затем разлагаются, регенерируя вещества, являющиеся катализаторами. В результате реакция идет, например, для уксусной кислоты по следующему уравнению:
![]()
Действие воды на дигалоидные соединения
Альдегиды и кетоны могут получаться при взаимодействии с водой дигалоидных соединений, содержащих оба атома галоида при одном и том же атоме углерода. При этом можно было бы ожидать обмена атомов галоида на гидроксилы и получения двухатомных спиртов, у которых обе гидроксильные группы находятся при одном и том же атоме углерода, например:
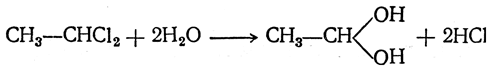
Но такие двухатомные спирты в обычных условиях не существуют, они отщепляют молекулу воды, образуя альдегиды или кетоны:
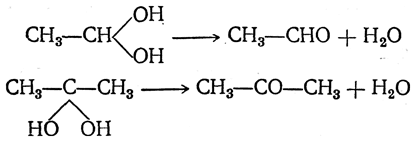
Таким образом, альдегиды и кетоны можно рассматривать как ангидриды двухатомных спиртов этого рода.
Действие воды на ацетиленовые углеводороды (реакция Кучерова)
При действии воды на ацетилен в присутствии солей окиси ртути получается уксусный альдегид:
![]()
При действии воды в тех же условиях на гомологи ацетилена получаются кетоны:
![]()
Эта реакция, открытая М. Г. Кучеровым в 1881—1884 гг., долгое время очень широко применялась и до сих пор не утратила своего значения для промышленного получения ацетальдегида, являющегося важным промежуточным продуктом в крупнотоннажных органических синтезах (уксусной кислоты, синтетических каучуков и т. п.).
Получение с помощью магний и цинкорганических соединений
Как было показано, при взаимодействии производных карбоновых кислот с некоторыми металлоорганическими соединениями присоединение одной молекулы металлоорганического соединения по карбонильной группе протекает по схеме
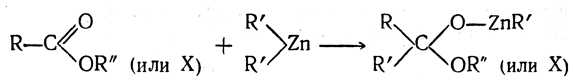
В случае производных муравьиной кислоты, например ее сложного эфира, реакция протекает следующим образом:
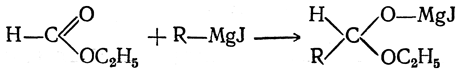
Если на полученные соединения подействовать водой, то они реагируют с ней с образованием в первом случае кетонов, а во втором — альдегидов:
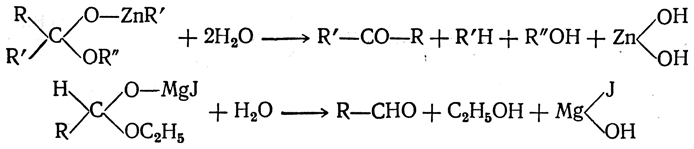
При указанных реакциях магнийорганических соединений приходится принимать различные меры, чтобы реакция не пошла дальше, вплоть до образования третичных спиртов.
И все же это удается лишь в ограниченном числе случаев. При действии магнийорганического соединения на сложный эфир чаще всего в реакцию вступает половина всего количества сложного эфира с образованием третичного спирта, а кетон вовсе не получается.
Практически наиболее удобным синтезом альдегидов при помощи металлоорганических соединений является получение их через посредство ацеталей из ортомуравьиного эфира СН(ОС2Н5)3, а также из амидов или нитрилов кислот.
При действии магнийорганических соединений на ортомуравьиный эфир происходит обмен радикала магнийорганического соединения на один из радикалов ОС2Н5 (этоксил), причем получается ацеталь альдегида (А. Е. Чичибабин, Бодру):
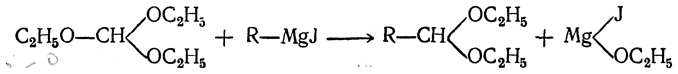
Ацеталь в присутствии кислоты омыляется, образуя альдегид:
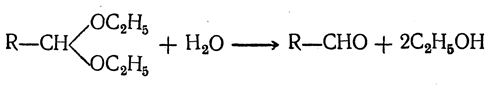
При действии на амид кислоты двух молекул магнийорганического соединения, а затем воды также получаются кетоны без образования третичных спиртов:
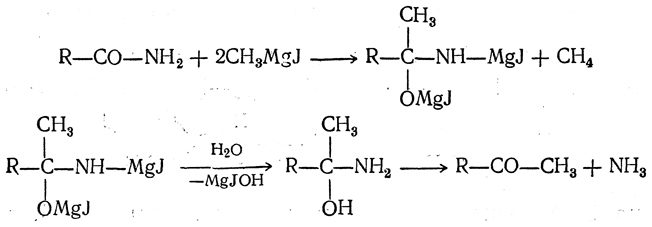
С формамидом по этой реакции получаются альдегиды. Сходно с амидами реагируют нитрилы кислот:
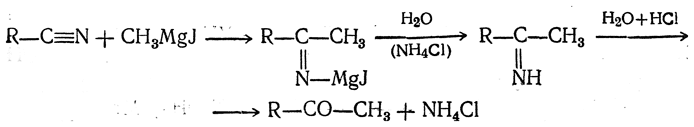
Действие кадмийорганических соединений на хлорангидриды кислот
Кадмийорганические соединения взаимодействуют с хлорангидридами кислот иначе, чем магний- или цинкорганические:
R—СО—Cl + C2H5CdBr → R—СО—С2Н5 + CdClBr
Поскольку кадмийорганические соединения не вступают в реакцию с кетонами, здесь не могут получаться третичные спирты.
Гидролиз виниловых эфиров
Альдегиды получаются при действии воды в присутствии минеральных кислот на простые виниловые эфиры (А. Е. Фаворский и М. Ф. Шостаковский):
![]()
Взаимодействие олефинов с окисью углерода и водородом (оксосинтез)
В присутствии кобальтового катализатора олефины реагируют в жидкой фазе при 150—250 ат и 100—200° С с окисью углерода и водородом. При этом получаются альдегиды, например:
![]()
Или
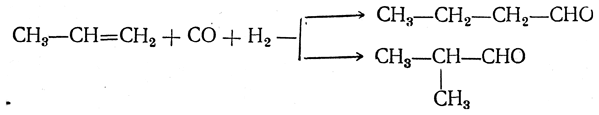
Фактически катализатором этой реакции являются карбонилы кобальта, образующиеся при взаимодействии кобальта с окисью углерода и действующие как гомогенный катализатор. Одновременно происходит частичное гидрирование альдегидов с образованием первичных спиртов. Этот процесс, называемый оксосинтезом, позволяет в промышленном масштабе получать различные первичные спирты из непредельных углеводородов.
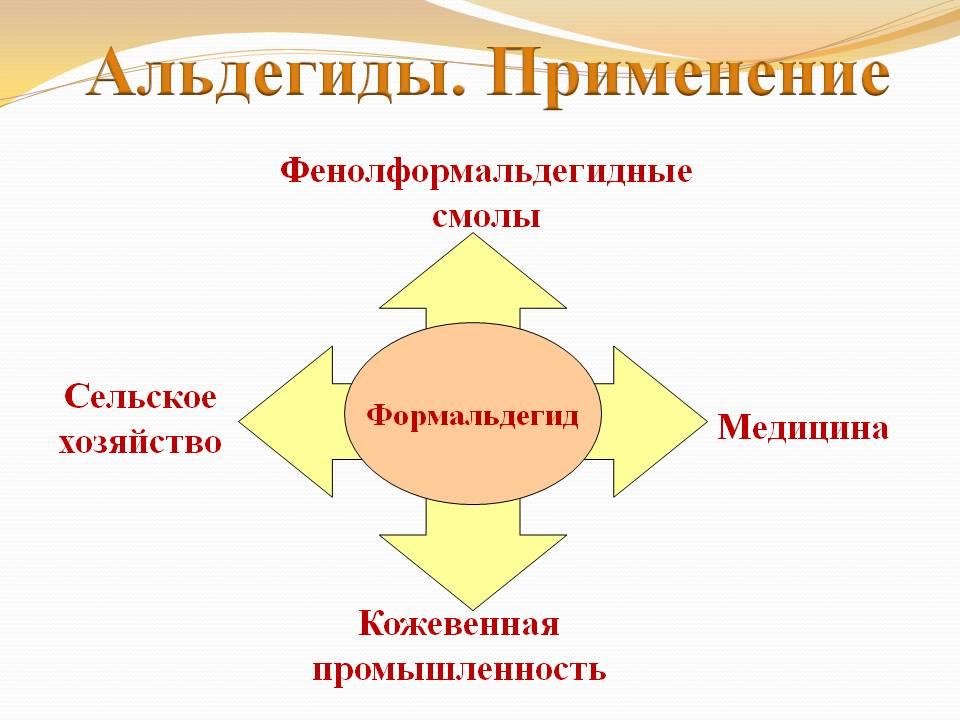
Применение альдегидов. 
Из альдегидов наибольшее применение имеет формальдегид.
 Особенности применения формальдегида: используется обычно в виде водного раствора – формалина; многие способы применения формальдегида основаны на свойстве свертывать белки; в сельском хозяйстве формалин необходим для протравливания семян; формалин применяется в кожевенном производстве; формалин оказывает дубящее действие на белки кожи, делает их более твердыми, негниющими; формалин применяется также для сохранения биологических препаратов; при взаимодействии формальдегида с аммиаком получается широко известное лекарственное вещество уротропин.
Особенности применения формальдегида: используется обычно в виде водного раствора – формалина; многие способы применения формальдегида основаны на свойстве свертывать белки; в сельском хозяйстве формалин необходим для протравливания семян; формалин применяется в кожевенном производстве; формалин оказывает дубящее действие на белки кожи, делает их более твердыми, негниющими; формалин применяется также для сохранения биологических препаратов; при взаимодействии формальдегида с аммиаком получается широко известное лекарственное вещество уротропин.

Основная масса формальдегида идет на получение фенолформальдегидных пластмасс, из которых изготавливаются: а) электротехнические изделия; б) детали машин и др. Ацетальдегид (уксусный альдегид) в больших количествах используется для производства уксусной кислоты.
Восстановлением ацетальдегида в некоторых странах получают этиловый спирт.


Применение альдегидов и кетонов.
Формальдегид Н2С=О (его водный раствор называют формалином) используют как дубитель кожи и консервант биологических препаратов.
Ацетон (СН3)2С=О – широко применяемый экстрагент и растворитель лаков и эмалей.
Ароматический кетон бензофенон (С6Н5)2С=О с запахом герани, используется в парфюмерных композициях и для ароматизации мыла.
Некоторые из альдегидов были сначала найдены в составе эфирных масел растений, а позже искусственно синтезированы.
Алифатический альдегид СН3(СН2)7С(Н)=О (тривиальное название – пеларгоновый альдегид) содержится в эфирных маслах цитрусовых растений, обладает запахом апельсина, его используют как пищевой ароматизатор.
Ароматический альдегид ванилин (рис. 10) содержится в плодах тропического растения ванили, сейчас чаще используется синтетический ванилин – широко известная ароматизирующая добавка в кондитерские изделия (рис. 10).
Рис. 10. ВАНИЛИН
Бензальдегид С6Н5С(Н)=О с запахом горького миндаля содержится в миндальном масле и в эфирном масле эвкалипта. Синтетический бензальдегид используется в пищевых ароматических эссенциях и в парфюмерных композициях.
Бензофенон (С6Н5)2С=О и его производные способны поглощать УФ-лучи, что определило их применение в кремах и лосьонах от загара, кроме того, некоторые производные бензофенона обладают противомикробной активностью и применяются в качестве консервантов. Бензофенон обладает приятным запахом герани, и потому его используют в парфюмерных композициях и для ароматизации мыла.
Способность альдегидов и кетонов участвовать в различных превращениях определила их основное применение в качестве исходных соединений для синтеза разнообразных органических веществ: спиртов, карбоновых кислот и их ангидридов, лекарственных препаратов (уротропин), полимерных продуктов (фенолоформальдегидные смолы, полиформальдегид), в производстве всевозможных душистых веществ (на основе бензальдегида) и красителей.
Химические свойства
Химические свойства альдегидов и кетонов обусловлены присутствием в их молекуле активной карбонильной группы, в которой двойная связь сильно поляризована в силу большой злектроотрицательности кислорода (С=0). В результате на карбонильном атоме углерода возникает заметный положительный заряд. Поэтому для альдегидов и кетонов характерны реакции присоединения по двойной связи С=0. Большинство из них протекает как нуклеофильное присоединение.
Кроме реакции присоединения по карбонильной группе, для альдегидов характерны также реакции с участием альфа-атомов водорода, соседних с карбонильной группой. Их реакционная способность связана с электроноакцепторным влиянием карбонильной группы, которое проявляется в повышенной полярности связи С—Н. Это приводит к тому, что альдегиды, в отличие от кетонов, легко окисляются. Их взаимодействие с аммиачным раствором оксида серебра является качественной реакцией на альдегиды.
Реакции нуклеофильного присоединения. Альдегиды и кетоны, обладая электрофильным центром, способны вступать во взаимодействие с нуклеофильными реагентами. Для оксосоединений наиболее характерны реакции, протекающие по механизму нуклеофильного присоединения, обозначаемому AN (от англ. addition nucleophilic).
Реакция с циановодородной (синильной) кислотой. Реакция имеет важное значение в органической химии. Во-первых, в результате реакции можно удлинить углеродную цепь; во-вторых, продукты реакции — гидроксинитрилы — служат исходными соединениями для синтеза гидроксикарбоновых кислот:
СН3—СН=O + Н—CN - СН3—CH(CN)—ОН
Взаимодействие со спиртами. Альдегиды могут взаимодействовать с одной или двумя молекулами спирта, образуя соответственно полуацетали и ацетали. Полуацеталями называются соединения, содержащие при одном атоме углерода гидроксильную и алкоксильную группы. Ацетали — это соединения, содержащие при одном атоме углерода две алкоксильные группы:
Реакцию получения ацеталей широко используют в органических синтезах для «защиты» активной альдегидной группы от нежелательных реакций:
СН3—СН=O + 2СН3ОН СН3—СН(ОСН3)—ОСН3 + Н2O
Присоединение гидросульфитов служит для выделения альдегидов из смесей с другими веществами и для получения их в чистом виде, поскольку полученное сульфопроизводное очень легко гидролизуется:
R—СН=0 + NaHS03 - R—СН(ОН)—S03Na
Присоединение реактива Гриньяра. В органическом синтезе чрезвычайно часто используется реактив Гриньяра — одно из простейших металлоорганических соединений. При добавлении раствора галогеналкана в диэтиловом эфире к магниевой стружке легко происходит экзотермическая реакция, магний переходит в раствор и образуется реактив Гриньяра:
R—X + Mg - R—Mg—X, где R — алкильный или арильный радикал, X — галоген
Взаимодействием реактива Гриньяра с формальдегидом можно получить практически любой первичный спирт (кроме метанола). Для этого продукт присоединения реактива Гриньяра гидролизуют водой:
Н2СО + RMgX - R—СН2—О—MgX - R—СН2—ОН
При использовании любых других алифатических альдегидов могут быть получены вторичные спирты:
Взаимодействием реактивов Гриньяра с кетонами получают третичные спирты:
(СН3)2С=0 + R—MgX - (CH3)2C(R)-0-MgX - (CH3)2C(R)-OH
Восстановление оксосоединений. См. восстановление карбонильных соединений в статье одноатомные алифатические спирты.
Реакции окисления. Альдегиды и кетоны по-разному относятся к действию окислителей. Альдегиды легко (значительно легче, чем спирты) окисляются в соответствующие карбоновые кислоты. Для их окисления можно использовать такие мягкие окислители, как оксид серебра и гидроксид меди (II). Кетоны к действию окислителей инертны, в частности они не окисляются кислородом воздуха. Кетоны реагируют только с очень сильными окислителями, способными разорвать углерод-углеродные связи в их молекуле.
Одной из качественных реакций для обнаружения альдегидной группы является реакция «серебряного зеркала» — окисление альдегидов оксидом серебра. Оксид серебра всегда готовят непосредственно перед опытом, добавляя к раствору нитрата серебра раствор гидроксида аммония:
AgN03 + NH4OH - NH4NO3 + AgOH
2AgOH - Ag20 + H20
Ag20 + 4NH3 + H20 - 2[Ag(NH3)2]OH
В растворе аммиака оксид серебра образует комплексное соединение, при действии которого на альдегид происходит окислительно-восстановительная реакция. Альдегид окисляется в соответствующую кислоту (точнее, в ее аммонийную соль), а комплексный катион восстанавливается до металлического серебра, которое дает блестящий налет на стенках пробирки — «серебряное зеркало»:
СН3—СН=0 + 2[Ag(NH3)2]OH - CH3COONH4 + 2Ag + 3NH3 + H20
Другая качественная реакция на альдегиды заключается в окислении их гидроксидом меди (II). При окислении альдегида светло-голубой гид роке ид меди (II) превращается в желтый гид роке ид меди (I) при комнатной температуре. Если подогреть раствор, то гидроксид меди (I) превращается в оксид меди (I) красного цвета, который плохо растворим в воде и выпадает в осадок:
СН3—СН=0 + 2Сu(ОН)2 - СН3СООН + 2СuОН + Н20
2CuOH - Cu20 + Н20
Окисление
Окисление алкенов может происходить в зависимости от условий и видов окислительных реагентов как с разрывом двойной связи, так и с сохранением углеродного скелета.
Окисление неорганическими окислителями
• В мягких условиях возможно окисление посредством присоединения по двойной связи двух гидроксильных групп[37]:
На первом этапе происходит присоединение оксида осмия к алкену, затем под действием воосстановителя (Zn или NaHSO3) образовавшийся комплекс переходит к диолу (Реакция Криге).
Аналогично реакция идет в нейтральной или слабощелочной среде под действием KMnO4 (Реакция Вагнера)[37]:
• При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде Н2SO4) при нагревании происходит разрыв двойной связи:
• Некоторые окислители, например нитрат (III) таллия, окисляют алкены с перегруппировкой по следующей схеме[37]:
Окисление в присутствии солей палладия
В присутствии солей палладия этилен окисляется до ацетальдегида[1]:
Реакция идет в кислой среде и является промышленным способом получения ацетальдегида.
Аналогично образуется ацетон из пропена.
Эпоксидирование При действии на алкены пероксикарбоновых кислот образуются эпоксиды (реакция Прилежаева)[38]:
Реакция эпоксидирования используется для промышленного получения этиленоксида. Окислителем выступает кислород воздуха; процесс идет на серебряном катализаторе при 200—250 °C под давлением.
Задания по теме для самостоятельного решения
Задание 1
(2 балла)Простейшее карбонильное соединение называется:
1) метанон; 2) уксусный альдегид; 3) ацетальдегид; 4) метаналь.
Задание 2
(2 балла)При гидрировании ацетальдегида образуется:
1) ацетилен;
2) уксусная кислота;
3) этанол;
4) этиленгликоль.
Задание 3
(2 балла)Какие соединения изомерны альдегидам с тем же числом атомов углерода:
а) кетоны; б) ароматические спирты; в) ацетали; г) циклические спирты ? .
1) а, б; 2) б, в; 3) в, г; 4) а, г.

