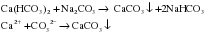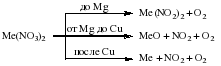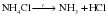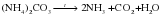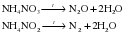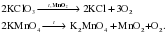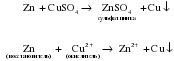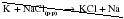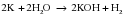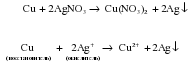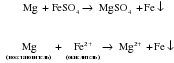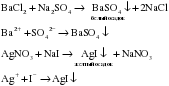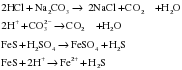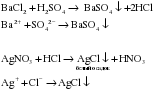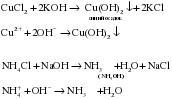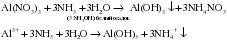Химические свойства солей
Разложение солей при нагревании
При изучении темы “Способы получения оксидов” вы уже изучили особенности разложения карбонатов и нитратов. В данном параграфе мы еще раз кратко рассмотрим разложение этих солей, а также познакомимся с реакциями разложения солей аммония, гидрокарбонатов и некоторых других солей.
А) Разложение карбонатов металлов.
Как вы уже знаете, карбонаты металлов разлагаются при нагревании, образуя оксид металла и углекислый газ:
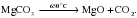
С увеличением активности металла температура разложения карбоната возрастает. Вспомните, карбонат кальция разлагается при температуре 900 оC.
Не разлагаются карбонаты щелочных металлов, кроме лития!
Б) Разложение гидрокарбонатов металлов.
Гидрокарбонаты разлагаются намного легче, чем карбонаты. Например, гидрокарбонаты кальция и магния не могут быть получены в виде индивидуальных веществ, они существуют только в растворах. При кипячении водных растворов этих веществ происходит их разложение с образованием нерастворимых карбонатов:

Гидрокарбонаты щелочных металлов более устойчивы, их можно получить в индивидуальном состоянии. Как и другие соли, они представляют собой твердые кристаллические вещества. Например, питьевая сода (NaHCO3) широко применяется в пищевой промышленности и имеется на кухне у каждой хозяйки. В отличие от средних солей гидрокарбонаты щелочных металлов разлагаются:
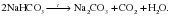

Интересно знать!
Соли кальция широко распространены в природе. Например, мел, мрамор и известняк представляют собой природные разновидности карбоната кальция (CaCO3). В больших количествах в природе встречаются гипс (CaSO4·2H2O), фосфорит (Ca3(PO4)2) и силикаты кальция. Соли кальция также почти всегда присутствуют в природной воде. Вода, содержащая большое количество солей кальция и магния (обычно это гидрокарбонаты, сульфаты и хлориды), называется жесткой, в противоположность мягкой воде, содержащей мало солей кальция и магния, либо совсем не содержащей их. Жесткость воды, обусловленная присутствием гидрокарбонатов кальция и магния (Ca(HCO3)2 и Mg(HCO3)2), называется временной жесткостью. При кипячении такой воды, например в электрочайнике, происходит разложение этих солей, и на поверхности нагревательного прибора образуется белый налет нерастворимого карбоната – “накипь”:
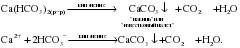
Вам известно, что соли имеют низкую тепло- и электропроводность. Поэтому налет карбоната кальция, покрывающий, например спираль электрочайника, препятствует передаче тепла от спирали к воде. В результате спираль перегревается и сгорает.

Как бороться с временной жесткостью воды? Очевидно, что прежде чем кипятить такую воду, следует удалить из нее ионы Ca2+ и Mg2+. Ведь именно эти ионы связывают в осадок анионы 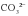 , образующиеся при кипячении жесткой воды, то есть ответственны за появление накипи. Ионы Ca2+ и Mg2+ можно перевести в осадок по реакции с кальцинированной содой (Na2CO3):
, образующиеся при кипячении жесткой воды, то есть ответственны за появление накипи. Ионы Ca2+ и Mg2+ можно перевести в осадок по реакции с кальцинированной содой (Na2CO3):
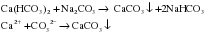
В образовавшейся воде вместо ионов Ca2+ и Mg2+ будут содержаться ионы Na+, не дающие осадков с карбонат-анионами. Какие еще ионы будут присутствовать в этой воде? Полученную воду можно смело кипятить в электрочайниках и использовать для стирки в стиральных машинах, не опасаюсь поломки дорогостоящего оборудования.
В) Разложение нитратов металлов.
Еще раз приведем схему разложения нитратов металлов:
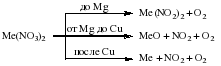
Обратите внимание, что нитраты магния и меди(II) разлагаются на оксид металла, NO2 и O2.
Г) Разложение солей аммония.
Соли аммония разлагаются с образованием аммиака и соответствующей кислоты:
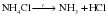
Если кислота термически неустойчива, то образуются продукты ее разложения:
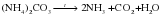
Обратите внимание, в отличие от других солей, при разложении солей аммония не образуются твердые вещества (сухой остаток). Все продукты в условиях реакции разложения являются газообразными и удаляются из реакционной системы.
Особым образом разлагаются нитрат и нитрит аммония. В этих реакциях аммиак не образуется, так как происходит его окисление:
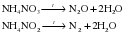
Д) Разложение других солей.
Мы рассмотрим разложение двух солей: бертолетовой соли (KClO3) и перманганата калия (KMnO4) или марганцовки. Разложение этих солей используют для получения кислорода в лаборатории:
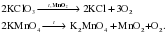
Реакции растворов солей с металлами
Более активные металлы вытесняют менее активные металлы из растворов солей:

![]()
![]()
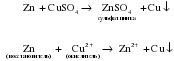
2e
Как и в случае взаимодействия металлов с кислотами (см. “Общие химические свойства кислот”), данная реакция является окислительно-восстановительной. В роли окислителя выступают ионы металла, входящего в состав соли (Cu2+), а простое вещество (Zn) является восстановителем. Так как окислительная способность ионов металлов увеличивается в ряду активности слева направо, то ионы Cu2+ (находятся правее) могут окислять Zn, но не наоборот!
Для вытеснения металла из раствора соли нельзя использовать щелочные и щелочноземельные металлы, так как они реагируют с имеющейся в растворе водой! Например, следующее уравнение реакции является неправильным:
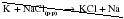
На самом деле при добавлении калия к раствору хлорида натрия будет бурно протекать реакция калия с водой:
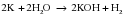
Чаще всего па практике металлами средней активности (Mg, Al, Zn, Fe) восстанавливают из солей малоактивные металлы (Cu, Ag и др.). Однако можно использовать и другие комбинации. Например, восстановить ионы серебра медью, или ионы Fe2+ магнием:

![]()
![]()
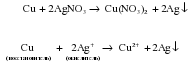
2e

![]()
![]()
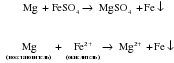
2e
Реакции ионного обмена
Протекание реакций ионного обмена с участием солей возможно в следующих случаях.
А) Между собой взаимодействуют две растворимые соли, при этом образуется осадок:
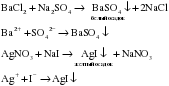
Б) Если соль образована слабой кислотой, то кислота, которая сильнее, вытесняет эту слабую кислоту из соли:
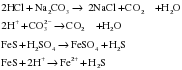
В) Раствор соли, образованной сильной кислотой, взаимодействует с раствором другой сильной кислоты, если выпадает осадок:
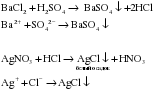
Г) Растворы солей реагируют со щелочами, если образуется нерастворимый гидроксид или NH4OH. Другими словами действует правило – сильное основание вытесняет слабое из соли:
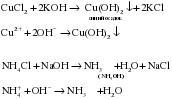
Выделяющийся из раствора аммиак легко обнаружить по характерному резкому запаху. Поэтому взаимодействие со щелочами является качественной реакцией на соли аммония!
Кроме того, гидроксид аммония вытесняет слабые основания и амфотерные гидроксиды из солей:
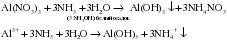


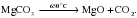

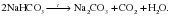



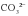 , образующиеся при кипячении жесткой воды, то есть ответственны за появление накипи. Ионы
, образующиеся при кипячении жесткой воды, то есть ответственны за появление накипи. Ионы