Кислоты – это электролиты, образующие при электролитической диссоциации в качестве катионов только катионы водорода. Число ионов водорода, способных образоваться в результате диссоциации одной молекулы кислоты, называется основностью кислоты. Кислоты могут быть одноосновными (HCl, HNO3) и многоосновными (H2SO4, H2CO3, H3PO4).
В зависимости от величины степени диссоциации кислоты делятся на сильные и слабые.
Сильные кислоты являются сильными электролитами, диссоциируют практически полностью, в растворе присутствуют только катионы водорода и анионы кислотного остатка, недиссоциированные молекулы отсутствуют. Примеры сильных кислот: HCl, HBr, HI, HNO3, H2SO4, HClO3, HClO4. В ионных уравнениях их формулы записывают в диссоциированном виде.
Слабые кислоты являются слабыми электролитами, диссоциированы в незначительной степени, в их водных растворах преобладают недиссоциированные молекулы, присутствует также небольшое количество катионов водорода и анионов кислотного остатка. Вследствие этого, в ионных уравнениях формулы таких электролитов следует писать в недиссоциированном виде. Примеры слабых кислот: H2CO3, H2SiO3, H2S, HСlO, Н3РО4, HF.
Диссоциация многоосновных кислот протекает ступенчато, то есть только часть ионов, образовавшихся на первой ступени, диссоциирует дальше. Отсюда следует, что записывать суммарное уравнение диссоциации многоосновной кислоты нельзя (исключение – серная кислота H2SO4, которая в разбавленном растворе диссоциирует практически полностью по двум ступеням).
Пример. Значения степени диссоциации ортофосфорной кислоты в 0,1 М растворе по отдельным ступеням:
Н3РО4 ⇆ Н+ + Н2РО4– I ступень, = 27 %
Н2РО4– ⇆ Н+ + НРО42– II cтупень, = 0,15 %
НРО42– ⇆ Н+ + РО43– III ступень, = 0,005 %.
Как видно, только небольшая часть анионов, образовавшихся на I ступени, подвергается дальнейшей диссоциации. Поэтому для слабых многоосновных кислот недопустимо писать суммарное уравнение диссоциации.
Таким образом, слабые кислоты присутствуют в водном растворе преимущественно в виде молекул. Поэтому в ионных уравнениях формулы слабых кислот следует записывать в молекулярной форме.
Например, для реакции, между фосфорной кислотой и щелочью, в которой на один моль кислоты приходится три моля щелочи, уравнение необходимо записывать следующим образом:
H3PO4 + 3NaOH = Na3PO4 + 3H2O
H3PO4 + 3Na+ + 3OH– = 3Na+ + PO43– + 3H2O
H3PO4 + 3OH– = PO43– + 3H2O.
Химические свойства кислот определяются, в первую очередь, наличием в их водных растворах катионов водорода. Растворы кислот обладают кислым вкусом, окрашивают лакмус в розовый, метилоранж – в красный цвет.
Кислоты взаимодействуют со следующими веществами.
Основания и амфотерные гидроксиды:
HCl + KOH = KCl + H2O
H+ + Cl– + K+ + OH- = K+ + Cl– + H2O
H+ + OH– = H2O (реакция нейтрализации);
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 + 2H+ + SO42– = Cu2+ + SO42– + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O.
Основные и амфотерные оксиды:
CuO + 2CH3COOH = (CH3COO)2Cu + H2O
CuO + 2CH3COOH = 2CH3COO– + Cu2+ + H2O;
ZnO + 2HNO3 = Zn(NO3)2 + H2O
ZnO + 2H+ = Zn2+ + H2O.
Соли более слабых кислот (сильная кислота вытесняет слабую из ее соли):
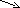
СО2
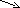
Na2CO3 + 2HCl = 2NaCl + H2CO3
H2O
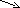
CO2
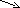
CO32– + 2H+ = H2CO3
H2O.
Металлы (стоящие в ряду напряжений до водорода):
Zn + 2HCl = ZnCl2 + H2
Zn + 2H+ = Zn2+ + H2.
Аммиак (образуются соли аммония):
НCl + NH3 = NH4Cl
Н+ + NH3 = NH4+.
Некоторые кислоты проявляют сильные окислительные свойства.