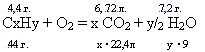Подготовка к ЕГЭ.
Занятие 2
Решение задач на вывод формул.
Задача 1
Газообразное органическое вещество имеет состав: 92,3 % углерода, 7,7 % водорода. Масса одного литра вещества 1,16 г. Определите молекулярную формулу вещества.
Задача 2
Газообразный углеводород, плотность которого по водороду 21, имеет состав: 85,7% углерода, 14,29 % водорода. Определите молекулярную формулу углеводорода.
Задача 3
Массовая доля атомов хлора в составе монохлорпроизводного алкана 55,04 %. Определите его молекулярную формулу.
Задача 4
Массовая доля атомов хлора в составе дихлорпроизводного алкана 0,7171. Какова его молекулярная формула ?
Задача 5
При сгорании 1,16 г вещества образовалось 3,52 г углекислого газа и 1,8 г воды. Относительная плотность по воздуху 2. Определите формулу вещества.
Задача 6
При сжигании в токе хлора 6,2 г некоторого вещества получили 21,9 г HCl, 30,8 г CCl4 и 10,3 г SCl2. Установите эмпирическую формулу вещества.
Задача 7
При сгорании 1,76 г органического вещества образовалось 3,52 г углекислого газа и 1,44 г воды. Плотность паров вещества по воздуху равна 1,52. Определите формулу вещества.
Задача 8
При полном сгорании порции вещества массой 11,8 г получено 17,6 г углекислого газа, 0,5 моль воды и 2,24 л (н.у.) азота. Относительная плотность вещества по азоту 2,11. Установите молекулярную формулу вещества.
Задача 9
При полном сгорании 3,84 г органического вещества получено 2,24 л (н.у.) углекислого газа, 1,8 г воды и 2,12 г карбоната натрия. Установите эмпирическую формулу вещества.
Задача 10
Газ, полученный при сжигании 3,6 г некоторого вещества, сначала пропустили через поглотитель с Р2О5 (масса поглотителя возросла на 5,4 г), а затем через известковую воду (получили 16,2 г кислой и 5,0 г средней соли). Установите формулу вещества.
Задача 11
При сгорании порции органического вещества, содержащего в составе элемент бром, получили 448 мл (н.у.) углекислого газа и 0,36 г воды. Весь бром, содержащийся в веществе, путем ряда превращений перевели в бромид серебра, масса которого составила 3,76 г. Плотность паров вещества по водороду равна 94. Установите молекулярную формулу вещества, если весь водород, входящий в состав вещества, перешел в состав воды.
Задача 12
Неизвестное вещество химическим количеством 4 моль сожгли и получили 4 моль углекислого газа, 2 моль азота и 10 моль воды. Установите молекулярную формулу вещества, если на его сжигание затратили 9 моль кислорода.
Задача 13
При полном сжигании газообразного соединения объёмом 2,24 л получили 4,48 л углекислого газа и 3,6 г воды. На сжигание потрачено 6,72 л (н.у.) кислорода. Определите молекулярную формулу вещества.
Задача 14
При реакции алкена с избытком хлора в темноте образуется 42,3 г дихлорида, а в такой же реакции с избытком бромной воды – 69,0 г дибромида. Установите молекулярную формулу алкена.
Задача 15
На гидрирование алкена затрачено 672 мл (н.у.) водорода, а при взаимодействии алкена с избытком бромной воды получено 6,48 г бромопроизводного. Какова молекулярная формула алкена ?
Задача 16
К 200 г 4%-ного раствора иодида одновалентного металла прибавили 0,0803 моль этой же соли. При этом массовая доля растворенного вещества увеличилась в 2,5 раза. Установите формулу соли.
Задача 17
При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
Задача 18
В результате реакции предельного одноатомного спирта с 18,25 г хлороводорода получили 46,25 г продукта реакции и воду. Определите молекулярную формулу спирта.
Задача 19
При окислении 1,12 л (н.у.) этиленового углеводорода избытком водного раствора перманганата калия образовался двухатомный спирт массой 3,80 г. Установите молекулярную формулу углеводорода.
Задача 20
Алкин массой 82,50 г полностью сожгли в избытке кислорода. Образовавшийся углекислый газ смешали с гелием объёмом (н.у.) 44,80 дм3. Молярная масса полученной при этом смеси газов составила 34,00 г/моль. Определите молярную массу алкина.
Задача 21
К некоторому объему алкана добавили в 10 раз больший объем смеси N2 и 02 с плотностью 1,357 г/л, после чего смесь взорвали в закрытом сосуде. Алкан сгорел полностью, а объемная доля N2 в полученной газовой смеси (н. у.) составила 50%. Установите формулу алкана.