Особенности химических свойств концентрированной и разбавленной серной кислоты
Оксиду серы(VI) – соответствует серная кислота H2SO4.
Серная кислота является сильной кислотой, она представляет собой тяжелую маслянистую жидкость плотностью 1,84 г/см3, нелетуча. С водой смешивается в любых соотношениях. Напомним: при приготовлении водных растворов H2SO4 следует добавлять небольшими порциями концентрированную серную кислоту к воде при перемешивании.
Серная кислота проявляет все свойства кислот: реагирует с основаниями, основными оксидами, солями более слабых и летучих кислот:
H2SO4 + 2NaOH = Na2SO4 + 2H2O;
H2SO4 + CuO = CuSO4 + H2O;
H2SO4 + Na2CO3 = Na2SO4 + H2O + CO2↑;
H2SO4(конц.) + NaCl(тв.) 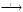 NaНSO4 + HCl↑.
NaНSO4 + HCl↑.
Особенности взаимодействия серной кислоты с металлами
Разбавленная серная кислота взаимодействует с металлами, которые расположены в электрохимическом ряду напряжений до водорода, как обычная кислота, то есть с выделением водорода:
Zn + H2SO4 = ZnSO4 + H2.
разбавл.
Концентрированная серная кислота является сильным окислителем, она способна окислять металлы, стоящие в электрохимическом ряду напряжений правее водорода (Cu, Ag, Hg):
Cu + 2H2SO4 = CuSO4 + SO2+ 2H2O.
конц.
При этом окислителем является сера в степени окисления +6. Чаще всего продуктом восстановления серы является SO2. При взаимодействии с активными металлами (Zn, Mg) могут образовываться сера и сероводород.
Некоторые металлы, такие как железо, алюминий, хром не реагируют с концентрированной H2SO4 без нагревания благодаря наличию защитной оксидной пленки. Свинец не реагирует с разбавленной серной кислотой вследствие образования защитной пленки из нерастворимого сульфата свинца PbSO4.
Золото и платину серная кислота не растворяет.
Серная кислота является важнейшим продуктом химической промышленности.
Основной метод промышленного получения серной кислоты – контактный. Сначала получают SO2 путем сжигания серы на воздухе, либо обжигом природных сульфидов металлов, в основном, пирита:
S + O2 = SO2;
4FeS2 +11O2 = 2Fe2O3 + 8SO2.
Далее, после тщательной очистки диоксид серы окисляют кислородом воздуха на катализаторе (V2O5):
2SO2 + O2 = 2SO3.
Окисление осуществляется в контактном аппарате, поэтому этот метод получения серной кислоты получил название контактный.
Заключительная стадия процесса получения серной кислоты – поглощение SO3 концентрированной серной кислотой. При этом образуется олеум – раствор SO3 в серной кислоте. Для получения серной кислоты олеум разбавляют раствором серной кислоты. Непосредственное поглощение триоксида серы водой использовать нельзя, так как при этом образуется туман из мельчайших капелек серной кислоты, что снижает эффективность процесса поглощения.
Серная кислота широко используется в промышленности для получения минеральных удобрений, очистки нефти, получения различных веществ. В нашей республике серная кислота производится на Гомельском химическом заводе и Гродненском производственном объединении “Азот”.
Сернистая и серная кислоты, будучи двухосновными, образуют два вида солей. Соли серной кислоты – сульфаты и гидросульфаты, сернистой кислоты – сульфиты и гидросульфиты. Сульфаты натрия Na2SO410H2О и магния MgSO47H2О используются в медицине; сульфат кальция СаSO42H2O (гипс) – в строительстве; сульфат алюминия Al2(SO4)3 – для очистки воды. Сульфит натрия Na2SO3 применяется в фотографии.
Качественной реакцией на сульфат-ионы SO42– является образование с ионами бария Ba2+ белого осадка BaSO4, нерастворимого в кислотах:
H2SO4 + Ba(NO3)2 = BaSO4 + 2HNO3;
SO42– + Ba2+ = BaSO4.


 Na
Na