Галогены.
На этом занятии мы рассмотрим характеристику элементов VIIA-группы на основании положения в периодической системе и строения атомов а также примеры решения расчетных задач и тестов ЕГЭ.
Конспект занятия "Галогены."
Галогены
Строение и свойства атомов.
Элементы главной подгруппы VII группы Периодической системы Д. И. Менделеева, объединенные под общим названием галогены, фтор F, хлор Сi, бром Вr, йод I, астат At (редко встречающийся в природе) — типичные неметаллы. Это и понятно, ведь их атомы содержат на внешнем энергетическом уровне семь электронов, и им недостает лишь одного электрона, чтобы завершить его. Атомы галогенов при взаимодействии с металлами принимают электрон от атомов металлов. При этом возникает ионная связь и образуются соли. Отсюда и происходит общее название подгруппы «галогены», т. е. рождающие соли.
Галогены — очень сильные окислители. Фтор в химических реакциях проявляет только окислительные свойства, и для него характерна только степень окислении -1 в соединениях. Остальные галогены проявляют и восстановительные свойства при взаимодействии с более электроотрицательными элементами — фтором, кислородом, азотом. Их степени окисления могут принимать значения +1, +3, +5, +7.Восстановительные свойства галогенов усиливаются от хлора к йоду, что связано с увеличением радиусов их атомов: атомы хлора примерно в полтора раза меньше, чем йода.
Галогены — простые вещества. Все галогены существуют в свободном состоянии в виде двухатомных молекул с ковалентной неполярной химической связью между атомами. В твердом состоянии F2, СI2, Вг2, I2 имеют молекулярные кристаллические решетки, что и подтверждается их физическими свойствами.
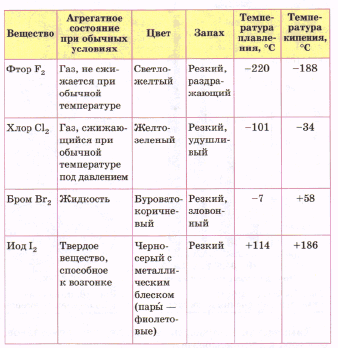
Как можно заметить, с увеличением молекулярной массы галогенов повышаются их температуры плавления и кипения ,возрастает плотность: фтор и хлор — газы, бром — жидкость, йод — твердое вещество. Это связано с тем, что с увеличением размеров атомов и молекул галогенов возрастают и силы межмолекулярного взаимодействия между ними.
От F2 к I2 усиливается интенсивность окраски галогенов. Кристаллы йода имеют металлический блеск.
Химическая активность галогенов, как неметаллов, от фтора к йоду ослабевает.
Каждый галоген является самым сильным окислителем в своем периоде. Окислительные свойства галогенов отчетливо проявляются при их взаимодействии с металлами. При этом образуются соли. Так, фтор уже при обычных условиях реагирует с большинством металлов, а при нагревании — и с золотом, серебром, платиной, известными своей химической пассивностью. Алюминий и цинк в атмосфере фтора воспламеняются:
Zn20+F20→Zn+2F2-1
Остальные галогены реагируют с металлами в основном при нагревании. Так, в колбе, наполненной хлором, красиво вспыхивают и сгорают кристаллики измельченной сурьмы , образуя при этом смесь двух хлоридов сурьмы (III) и (V)
2Sb0+3Ci20→2Sb+3Ci3-1
2Sb0+5Ci20→2Sb+3Ci5-1

Нагретый порошок железа также загорается при взаимодействии с хлором.
2Fe0+3Ci20→2Fe+3Ci3-1
Йод окисляет металлы медленнее, но в присутствии воды, которая является катализатором, реакция йода с порошком алюминия протекает очень бурно:
2Al0+3I20→2Al+3I3-1

Об уменьшении окислительных и увеличении восстановительных свойств галогенов от фтора к йоду можно судить по их способности вытеснять друг друга из растворов солей.
Так, хлор вытесняет бром и йод из растворов их солей, Свободный бром вытесняет йод из солей.
Ослабление окислительных свойств галогенов от фтора к йоду наглядно проявляется при взаимодействии их с водородом. Уравнение этой реакции можно записать в общем виде так:
Н2 + Г2 = 2НГ
Если фтор взаимодействует с водородом в любых условиях со взрывом, то смесь хлора с водородом реагирует со взрывом только при поджигании или облучении прямым солнечным светом, бром взаимодействует с водородом при нагревании и без взрыва. Эти реакции экзотермические. Реакция же соединения кристаллического йода с водородом слабо эндотермическая, она протекает медленно даже при нагревании.
В результате этих реакций образуются соответственно фтороводород HF, хлороводород НСI, бромоводород НВг и йодоводород HI.
Хлор

Хлор СI2 представляет собой зеленовато-жёлтый газ с едким запахом, он примерно в два с половиной раза тяжелее воздуха. При работе с хлором нужно помнить о том, что этот газ ядовит! 
Хлор легко сгущается в жидкость при охлаждении или повышении давления. В 100 объёмах воды при 0 0С растворяется 150 объёмов хлора.
Подобно кислороду, хлор вступает в реакцию со многими простыми веществами. Он взаимодействует даже с золотом, на которое кислород не действует. Многие вещества горят в хлоре, т. е. энергично взаимодействуют с ним с выделением тепла и света. Тонкий листок золотой фольги в сосуде с хлором вспыхивает и превращается в хлорид золота(III). Оседающий на стенках сосуда в виде золотисто-коричневых кристаллов:
2Au + ЗСI2 → 2АuСI3.
С хлором легко вступают в реакцию и многие другие металлы, а также некоторые неметаллы - водород, сера, фосфор. Для проведения реакции водорода с хлором водород, получаемый в аппарате Киппа, зажигают на воздухе у конца газоотводной трубки, а затем вводят её в цилиндр, заполненный хлором. Горение водорода продолжается, однако пламя изменяет цвет. В ходе этой реакции образуется газ хлороводород:
Н2 + СI2 → 2НСI.
Во всех этих реакциях хлор является окислителем. Атомы хлора присоединяют по одному электрону, приобретая степень окисления -1. Хлор, наряду с кислородом —один из важнейших окислителей.


Бром

При -7,2°С жидкий Бром застывает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском. Пары Брома желто-бурого цвета, t кип 58,78°С. Плотность жидкого Бром (при 20°С) 3,1 г/см3. В воде Бром растворим ограниченно, но лучше других галогенов (3,58 г Брома в 100 г Н2О при 20°С). Ниже 5,84°С из воды осаждаются гранатово-красные кристаллы Br2·8Н2О. Особенно хорошо растворим Бром во многих органических растворителях, чем пользуются для извлечения его из водных растворов. Бром в твердом, жидком и газообразном состоянии состоит из 2-атомных молекул. Заметная диссоциация на атомы начинается при температуре около 800°С; диссоциация наблюдается и при действии света.
Конфигурация внешних электронов атома Бром 4s24p5. Валентность Брома в соединениях переменна, степень окисления равна -1 (в бромидах, например КВr), +1 (в гипобромитах, NaBrO), +3 (в бромитах, NaBrO2), +5 (в броматах, КВrОз) и +7 (в перброматах, NaBrO4). Химически Бром весьма активен, занимая по реакционной способности место между хлором и йодом. Взаимодействие Брома с серой, селеном, теллуром, фосфором, мышьяком и сурьмой сопровождается сильным разогреванием, иногда даже появлением пламени. Так же энергично Бром реагирует с некоторыми металлами, например, калием и алюминием. Однако многие металлы реагируют с безводным Бромом с трудом из-за образования на их поверхности защитной пленки бромида, нерастворимого в Броме. Из металлов наиболее устойчивы к действию Брома, даже при повышенных температурах и в присутствии влаги, серебро, свинец, платина и тантал (золото, в отличие от платины, энергично реагирует с Бромом). С кислородом, азотом и углеродом Бром непосредственно не соединяется даже при повышенных температурах. Соединения Брома с этими элементами получают косвенным путем. Таковы крайне непрочные оксиды Вr2О, ВrО2 и Вr3О8 (последний получают, например, действием озона на Бром при 80°С). С галогенами Бром взаимодействует непосредственно, образуя BrF3, BrF5, BrCl, IBr и другие.
Бром - сильный окислитель. Так, он окисляет сульфиты и тиосульфаты в водных растворах до сульфатов, нитриты до нитратов, аммиак до свободного азота:
3Br2 + 8NH3 → N2 + NH4Br
Бром вытесняет йод из его соединений, но сам вытесняется хлором и фтором. Свободный Бром выделяется из водных растворов бромидов также под действием сильных окислителей (KMnO4, K2Cr2O7) в кислой среде. При растворении в воде Бром частично реагирует с ней с образованием бромистоводородной кислоты НВг и неустойчивой бромноватистой кислоты НВгО.
Br2 + H2O →HBr + HBrO
Раствор Брома в воде называется бромной водой. При растворении Брома в растворах щелочей на холоде происходит образование бромида и гипобромита, а при повышенных температурах (около 100°С) - бромида и бромата.
6NaOH + 3Br2 → 5NaBr + NaBrO3 + 3H2O
2NaOH + Br2 →NaBr + NaBrO + H2O
Из реакций Брома с органическими соединениями наиболее характерны присоединение по двойной связи С=С, а также замещение водорода (обычно при действии катализаторов или света).
Фтор

Газообразный Фтор имеет плотность 1,693 г/л , жидкий - 1,5127 г/см3 (при температуре кипения); t пл -219,61 °С; t кип -188,13 °С. Молекула Фтора состоит из двух атомов (F2); при 1000 °С 50% молекул диссоциирует, энергия диссоциации около 155 кДж/моль (37 ккал/моль). Фтор плохо растворим в жидком фтористом водороде; растворимость 2,5·10-3 г в 100 г HF при -70 °С и 0,4·10-3 г при -20 °С; в жидком виде неограниченно растворим в жидком кислороде и озоне.
Конфигурация внешних электронов атома Фтора 2s22p5. В соединениях проявляет степень окисления -1. Фтор реагирует со всеми элементами, кроме гелия, неона и аргона. С кислородом взаимодействует в тлеющем разряде, образуя при низких температурах фториды кислорода O2F2, O3F2 и другие. Реакции Фтора с других галогенами экзотермичны, в результате образуются межгалогенные соединения. Хлор взаимодействует с Фтором при нагревании до 200-250 0С, давая монофтористый хлор ClF и трехфтористый хлор ClF3. Известен также ClF5, получаемый фторированием ClF3 при высоких температуре и давлении. Бром и йод воспламеняются в атмосфере Фтора при обычной температуре, при этом могут быть получены BrF3, BrF5, IF3, IF2. Фтор непосредственно реагирует с криптоном, ксеноном и радоном, образуя соответствующие фториды (например, XeF4, XeF6, KrF2). Известны также оксифториды ксенона.
Взаимодействие Фтора с серой сопровождается выделением тепла и приводит к образованию многочисленных фторидов серы. Селен и теллур образуют высшие фториды SeF6 и TeF6. Фтор с водородом реагируют с воспламенением; при этом образуется фтористый водород. Это радикальная реакция с разветвлением цепей:
HF* + Н2 → HF + Н2*; Н2* + F2 →HF + Н + F
(где HF* и Н2* - молекулы в колебательно-возбужденном состоянии); реакция используется в химических лазерах. Фтор с азотом реагирует лишь в электрическом разряде. Древесный уголь при взаимодействии с Фтором воспламеняется при обычной температуре; графит реагирует с ним при сильном нагревании, при этом возможно образование твердого фтористого графита (CF)Х или газообразных перфторуглеродов CF4, C2F6 и других. С бором, кремнием, фосфором, мышьяком Фтор взаимодействует на холоде, образуя соответствующие фториды.
Фтор энергично соединяется с большинством металлов; щелочные и щелочноземельные металлы воспламеняются в атмосфере Фтора на холоде, Bi, Sn, Ti, Mo, W - при незначительном нагревании. Hg, Pb, U, V реагируют с Фтором при комнатной температуре, Pt - при температуре темнокрасного каления. При взаимодействии металлов с Фтор образуются, как правило, высшие фториды, например UF6, MoF6, HgF2. Некоторые металлы (Fe, Cu, Al, Ni, Mg, Zn) реагируют с Фтором с образованием защитной пленки фторидов, препятствующей дальнейшей реакции.
При взаимодействии Фтора с оксидами металлов на холоде образуются фториды металлов и кислород; возможно также образование оксифторидов металлов (например, MoO2F2). Оксиды неметаллов либо присоединяют Фтор, например :
SO2 + F2 → SO2F2
Либо кислород в них замещается на Фтор, например:
SiO2 + 2F2 → SiF4 + О2
Стекло очень медленно реагирует с Фтором; в присутствии воды реакция идет быстро. Вода взаимодействует с Фтором:
2Н2О + 2F2 → 4HF + О2;
При этом образуется также OF2 и пероксид водорода Н2О2. Оксиды азота NO и NO2 легко присоединяют Фтор с образованием соответственно фтористого нитрозила FNO и фтористого нитрила FNO2. Оксид углерода (II) присоединяет Фтор при нагревании с образованием фтористого карбонила:
СО + F2 → COF2
Гидрооксиды металлов реагируют с Фтором, образуя фторид металла и кислород, например 2Ва(ОН)2 + 2F2 → 2BaF2 + 2Н2О + О2. Водные растворы NaOH и KOH реагируют с Фтором при 0°С с образованием OF2.
Галогениды металлов или неметаллов взаимодействуют с Фтором на холоде, причем Фтор замещает все галогены.
Легко фторируются сульфиды, нитриды и карбиды. Гидриды металлов образуют с Фтором на холоде фторид металла и HF; аммиак (в парах) - N2 и HF. Фтор замещает водород в кислотах или металлы в их солях, например:
НNО3(или NaNO3) + F2 → FNO3 + HF (или NaF)
В более жестких условиях Фтор вытесняет кислород из этих соединений, образуя сульфурилфторид, например:
Na2SO4 + 2F2 →2NaF +SO2F2 + O2
Карбонаты щелочных и щелочноземельных металлов реагируют с Фтором при обычной температуре; при этом получаются соответствующий фторид, СО2 и О2.
Йод

Плотность Йода 4,94 г/см3, tпл 113,5°C, t кип 184,35 °С. Молекула жидкого и газообразного Йода состоит из двух атомов (I2). Заметная диссоциация I2 = 2I наблюдается выше 700 °C, а также при действии света. Уже при обычной температуре Йод испаряется, образуя резко пахнущий фиолетовый пар. При слабом нагревании Йод возгоняется, оседая в виде блестящих тонких пластинок; этот процесс служит для очистки Йода в лабораториях и в промышленности. Йод плохо растворим в воде (0,33 г/л при 25 °C), хорошо - в сероуглероде и органических растворителях (бензоле, спирте и других), а также в водных растворах иодидов.
Конфигурация внешних электронов атома Йода 5s25p5. B соответствии с этим Йод проявляет в соединениях переменную валентность (степень окисления): -1 (в HI, KI), +1 (в HIO, KIO), +3 (в ICl3), +5 (в HIO3, KIO3) и +7 (в HIO4, KIO4). Химически Йод довольно активен, хотя и в меньшей степени, чем хлор и бром. С металлами Йод при легком нагревании энергично взаимодействует, образуя иодиды:
Hg + I2 → HgI2
С водородом Йод реагирует только при нагревании и не полностью, образуя Йодистый водород. С углеродом, азотом, кислородом Йод непосредственно не соединяется. Элементарный Йод - окислитель, менее сильный, чем хлор и бром. Сероводород H2S, тиосульфат натрия Na2S2O3 и другие восстановители восстанавливают его до I-:
I2 + H2S → S + 2HI
Хлор и другие сильные окислители в водных растворах переводят его в IO3- :
5Cl2 + I2 + 6H2O → 2HIO3H + 10НСl
При растворении в воде Йод частично реагирует с ней:
I2 + H2O → HI + HIO
В горячих водных растворах щелочей образуются йодид и йодат:
3I2 + 6NaOH → 5NaI + NaIO3 + 3H2O
Адсорбируясь на крахмале, Йод окрашивает его в темно-синий цвет; это используется в йодометрии и качественном анализе для обнаружения Йода.
Пары Йода ядовиты и раздражают слизистые оболочки. На кожу йод оказывает прижигающее и обеззараживающее действие. Пятна от Йода смывают растворами соды или тиосульфата натрия. 
Получение галогенов.
Биологическое значение и применение галогенов и их соединений.
Получение галогенов. В промышленности фтор и хлор получают электролизом расплавов или растворов их солей. Модели лабораторных установок для электролитического получения хлора изображены на рисунке. Например, процесс электролиза расплава хлорида натрия можно отразить уравнением:
![]()
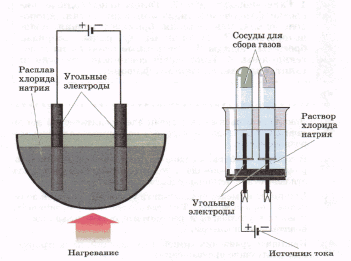
При получении хлора электролизом раствора хлорида натрия кроме хлора образуются также водород и гидроксид натрия:
2NaCl + 2Н20→Н2↑+CI2↑+ 2NaOH
Но если водород можно получить другими, более удобными и дешевыми способами, например из природного газа, то гидроксид натрия, как и хлор, получают почти исключительно электролизом раствора поваренной соли.
В лаборатории хлор получают взаимодействием соляной кислоты с оксидом марганца:
MnO2+4HCI→MnCI2+CI2↑+2H2O
Основным способом получения простых веществ является окисление галогенидов. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде:
![]()
полуреакция на катоде:
![]()
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался RuO2).
В современных электролизёрах катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na+ переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl− в Cl2) и накапливаются у катода (образование OH−). Перемещение OH− в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH− реагировал бы с Cl2 и сводил на нет весь результат.
Бром получают химическим окислением бромид-иона, находящегося в морской воде. Подобный процесс используется и для получения йода из природных рассолов, богатых I−. В качестве окислителя в обоих случаях используют хлор, обладающий более сильными окислительными свойствами, а образующиеся Br2 и I2 удаляются из раствора потоком воздуха.
Биологическое значение галогенов. Их применение.
Фтор.
Можно заметить, что на этикетках многих марок зубных паст указывают содержание в них фтора — конечно, не свободного, а его соединений. Благодаря этому важному компоненту, участвующему в построении зубной эмали и костей, предотвращается такое заболевание, как кариес зубов.

Кроме того, фтор является необходимым элементом в процессах обмена веществ в железах, мышцах и нервных клетках.
Важное значение имеет фтор и в промышленном производстве, где основные потребители его — ядерная промышленность и электротехника. Его соединение Na3AlF6 используют для производства алюминия. А в быту все более широкое применение находит тефлоновая посуда, название которой дано по фторсодержащей пластмассе — тефлону.
Хлор.
Хлор. Один из химических элементов, без которых немыслимо существование живых организмов. Основная форма его поступления в организм — это хлорид натрия, который стимулирует обмен веществ, рост волос, придает бодрость и силу. Больше всего хлорида натрия NaCl содержится в плазме крови.
Особую роль в пищеварении играет соляная кислота НСI, которая входит в состав желудочного сока. Без 0,2%-й соляной кислоты практически прекращается процесс переваривания пищи. И хотя почти все пищевые продукты содержат некоторое количество поваренной соли, человек вынужден добавлять к пище ежедневно около 20 г соли.
По масштабам промышленного применения хлор намного превосходит все галогены. Хлор и его соединения необходимы для отбеливания льняных и хлопчатобумажных тканей, бумаги и т. д. Особенно много его расходуют в органическом синтезе для производства пластмасс, каучуков, красителей и растворителей. Многие хлорсодержащие соединения используют для борьбы с вредителями сельского хозяйства. В больших количествах соединения хлора (хлорная известь) необходимы для обеззараживания питьевой воды, правда, далеко не без отрицательных последствий. В цветной металлургии методом хлорирования руд извлекают из них некоторые металлы (титан, ниобий, тантал). Хлор применялся и в военных целях в качестве боевого отравляющего вещества.


Хлор содержится в очень опасном для жизни и здоровья веществе — диоксине. Соединения хлора — одна из причин разрушения озонового слоя Земли.
Бром.
Еще один галоген — бром также весьма важен для организма человека. Соединения этого элемента регулируют процессы возбуждения и торможения центральной нервной системы, поэтому для лечения нервных болезней (бессонницы, истерии, неврастении и т. д.) врачи прописывают «бром» бромсодержащие препараты.
Бром активно накапливают некоторые растения, и в том числе морские водоросли. Именно в море сосредоточена большая часть брома на нашей планете, и море служит главным поставщиком брома. Подсчитано, что ежегодно вместе с морской водой в воздух переходит около 4 млн т брома. Понятно, что содержание его в воздухе приморских районов всегда больше, чем в районах, далеких от моря. Это одна из причин, почему так полезно дышать морским воздухом.

Йод.
Йод — это тот элемент, без которого человек не может жить: недостаток его в воде и пище снижает выработку гормона щитовидной железы и приводит к заболеванию эндемическим зобом. Гормон щитовидной железы регулирует мускульное возбуждение, биение сердца, аппетит, пищеварение, работу мозга. Йод поступает в организм вместе с пищей: хлебом, яйцами, молоком, водой, морской капустой и с воздухом (особенно морским) при дыхании.

Спиртовой раствор йода (5—10%-й), называемый йодной настойкой, применяют для обработки ран. Йод входит в состав многих лекарств.
Главными потребителями йода являются фармацевтическая и химическая промышленность.
Задания по теме для самостоятельного решения
Задание 1
(2 балла)При взаимодействии хрома с соляной кислотой образуются:
- CrCl2 и Н2
- CrCl3 и Н2О
- CrCl2 и Н2О
- CrCl3 и Н2
Задание 2
(2 балла)Валентность атомов хлора совпадает в веществах пары:
- Cl2O и HClO3
- PCl3 и Cl2O7
- SCl2 и HClO3
- Cl2 и HCl
Задание 3
(2 балла)Степень окисления +7 хлор проявляет в каждом из двух соединений:
- Ca(OCl)2 и Cl2O7
- KClO3 и ClO2
- BaCl2 и HClO4
- Mg(ClO4)2 и Cl2O7

