1.Общая характеристика подгрупп азот и фосфор
Азот и фосфор - типичные неметаллы.
Азот при обычных условиях - газ без цвета и запаха, состоящий из двухатомных молекул N2. Азот - основной компонент воздуха (78% по объему). Кроме того, азот входит в состав растений и организмов животных в форме белков. Растения синтезируют белки, используя нитраты из почвы. Нитраты образуются там из атмосферного азота и аммонийных соединений, имеющихся в почве. Процесс превращения атмосферного азота в форму, усвояемую растениями и животными, называется связыванием (или фиксацией) азота. Связывание азота может происходить двумя способами:
1) Во время разряда молний некоторое количество азота и кислорода в атмосфере соединяется с образованием оксидов азота. Они растворяются в воде, образуя разбавленную азотную кислоту, которая, в свою очередь, образует нитраты в почве.
2) Атмосферный азот под действием особых бактерий непосредственно превращается в нитраты. Некоторые из таких бактерий присутствуют в почве, другие - в узелках корневой системы клубеньковых растений.
 Азот
Азот
Фосфор - «элемент-одиночка»; известен его единственный стабильный изотоп 31Р. Фосфор, как и азот, тоже является одним из незаменимых для жизни элементов и входит в состав всех живых организмов. Он содержится в костных тканях и необходим животным в процессах обмена веществ для накопления энергии. Простое вещество при обычных условиях существует в виде целого ряда аллотропных модификаций, точное число которых до сих пор является предметом дискуссий. Главные из них - белый, красный и черный фосфор, которые при определенных условиях могут взаимопревращаться.
 Фосфор
Фосфор
2.Строение атомов азота и фосфора
 Молекула фосфора
Молекула фосфора
 Молекула азота
Молекула азота
Распределение электронов в атоме азота:ls22s22p3.
Распределение электронов в атоме фосфора: ls22s22p63s23p33d°.
Характерная валентность для атомов азота и фосфора в невозбужденном состоянии равна III, в возбужденном состоянии — V. Это состояние возможно только для фосфора и других элементов V группы за исключением азота, так как на втором энергетическом уровне нет d-подуровня. Азот не бывает пятивалентным, но степень окисления, как условный заряд, может быть +5.
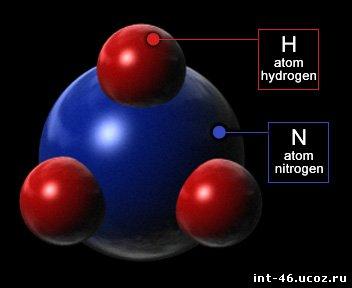
 Атом азота
Атом азота
 Атом фосфора
Атом фосфора
3.Аммиак
Аммиа́к — NH3,при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта).Аммиак почти вдвое легче воздуха.астворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
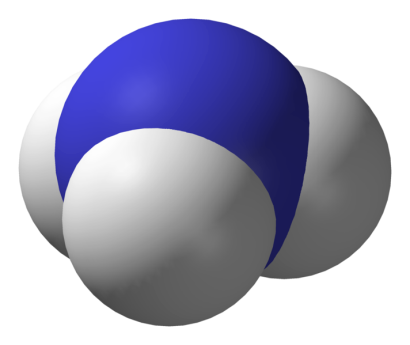 Молекула аммиака
Молекула аммиака
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь (не следует путать понятия «нуклеофил» и «основание Бренстеда».Нуклеофильность определяется сродством к положительно заряженной частице. Основание имеет сродство к протону. Понятие «основание» является частным случаем понятия «нуклеофил»). Так, он присоединяет протон, образуя ион аммония.Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию.Взаимодействуя с кислотами даёт соответствующие соли аммония.Жидкий аммиак, хотя и в незначительной степени, диссоциирует на ионы (автопротолиз), в чём проявлется его сходство с водой.
Аммиак является конечным продуктом азотистого обмена в организме человека и животных. Он образуется при метаболизме белков, аминокислот и других азотистых соединений. Он высоко токсичен для организма, поэтому большая часть аммиака в ходе орнитинового цикла конвертируется печенью в более безвредное и менее токсичное соединение — карбамид (мочевину). Мочевина затем выводится почками, причём часть мочевины может быть конвертирована печенью или почками обратно в аммиак.
Аммиак может также использоваться печенью для обратного процесса — ресинтеза аминокислот из аммиака и кетоаналогов аминокислот. Этот процесс носит название «восстановительное аминирование».
 Мочевина
Мочевина
Пары аммиака сильно раздражают слизистые оболочки глаз и органов дыхания, а также кожные покровы. Это человек и воспринимает как резкий запах. Пары аммиака вызывают обильное слезотечение, боль в глазах, химический ожог конъюнктивы и роговицы, потерю зрения, приступы кашля, покраснение и зуд кожи. При соприкосновении сжиженного аммиака и его растворов с кожей возникает жжение, возможен химический ожог с пузырями, изъязвлениями.Аммиак относится к числу важнейших продуктов химической промышленности, ежегодное его мировое производство достигает 150 млн тонн. В основном используется для производства азотных удобрений (нитрат и сульфат аммония, мочевина), взрывчатых веществ и полимеров, азотной кислоты, соды (по аммиачному методу) и других продуктов химической промышленности. Жидкий аммиак используют в качестве растворителя.
 Перевозка аммиака
Перевозка аммиака
В холодильной технике используется в качестве холодильного агента (R717)
В медицине 10 % раствор аммиака, чаще называемый нашатырным спиртом, применяется при обморочных состояниях (для возбуждения дыхания), для стимуляции рвоты, а также наружно — невралгии, миозиты, укусах насекомых, для обработки рук хирурга. При неправильном применении может вызвать ожоги пищевода и желудка (в случае приёма неразведённого раствора), рефлекторную остановку дыхания (при вдыхании в высокой концентрации).
Применяют местно, ингаляционно и внутрь. Для возбуждения дыхания и выведения больного из обморочного состояния осторожно подносят небольшой кусок марли или ваты, смоченный нашатырным спиртом, к носу больного (на 0,5-1 с). Внутрь (только в разведении) для индукции рвоты; также, в составе нашатырно-анисовых капель - в качестве муколитического (отхаркивающего) средства. При укусах насекомых — в виде примочек; при невралгиях и миозитах — растирания аммиачным линиментом. В хирургической практике разводят в тёплой кипяченой воде и моют руки.
Поскольку аммиак является слабым основанием, при взаимодействии с кислотами он их нейтрализует.
4.Соли амония

Со́лиаммо́ния — соли, содержащие аммоний, NH4+; по строению, цвету и другим свойствам они похожи на соответствующие соли натрия. Все соли аммония хорошо растворимы в воде и полностью диссоциируют в водном растворе. Соли аммония проявляют общие свойства солей. При действии на них щёлочи выделяется газообразный аммиак. Все соли аммония при нагревании разлагаются. Получают их при взаимодействии аммиака или гидроксида аммония с кислотами.
Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов;
Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение;
 Азотное удобрение
Азотное удобрение
Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине;
Хлорид аммония (нашатырь) NH4Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии, в медицине.
Химические свойства солей аммония:
1.Сильные электролиты (диссоциируют в водных растворах).
2.Разложение при нагревании:
а) если кислота летучая
NH4Cl → NH3↑ + HCl
NH4HCO3 → NH3↑ + Н2O + CO2
б) если анион проявляет окислительные свойства
NH4NO3 → N2O↑ + 2Н2O
(NH4)2Cr2O7 → N2↑ + Cr2O3+ 4Н2O
3.С кислотами (реакция обмена):
(NH4)2CO3 + 2HCl → 2NH4Cl + Н2O + CO2 ↑
4.C солями (реакция обмена):
(NH4)2SO4 + Ba(NO3)2 → BaSO4 ↓ + 2NH4NO3
5.Соли аммония подвергаются гидролизу (как соль слабого основания и сильной кислоты) — среда кислая:
NH4Cl + Н2O ↔ NH4OH + HCl
6.При нагревании со щелочами выделяют аммиак (качественная реакция на ион аммония)
NH4Cl + NaOH → NaCl + NH3 ↑ + Н2O
4.Азотная кислота

Азо́тная кислота́ (HNO3), — сильная одноосновная кислота. Твёрдая азотная кислота образует две кристаллические модификации с моноклинной и ромбической решётками.
Азотная кислота смешивается с водой в любых соотношениях. В водных растворах она практически полностью диссоциирует на ионы.
Азот в азотной кислоте четырёхвалентен[2], степень окисления +5. Азотная кислота — бесцветная, дымящая на воздухе жидкость, температура плавления −41,59 °C, кипения +82,6 °C с частичным разложением. Растворимость азотной кислоты в воде не ограничена. Водные растворы HNO3 с массовой долей 0,95-0,98 называют «дымящей азотной кислотой», с массовой долей 0,6-0,7 — концентрированной азотной кислотой. С водой образует азеотропную смесь (массовая доля 68,4 %, d20 = 1,41 г/см, Tкип = 120,7 °C)
Высококонцентрированная HNO3 имеет обычно бурую окраску вследствие происходящего на свету процесса разложения.
5.Нитраты
Нитрат (лат. nitras; устар. селитры) — соль азотной кислоты, содержит однозарядный анион NO3−.
Устаревшее название — селитры — в настоящее время используется преимущественно в минералогии, как название для минералов, а также для удобрений в сельском хозяйстве.
 Прибор для измерения нитратов.
Прибор для измерения нитратов.
Нитраты получают действием азотной кислоты HNO3 на металлы, оксиды, гидроксиды, соли. Практически все нитраты хорошо растворимы в воде.
Нитраты устойчивы при обычной температуре. Они обычно плавятся при относительно низких температурах (200—600 °C), зачастую с разложением.
Основное применение нитратов — удобрения (селитры), взрывчатые вещества (аммониты) и другие.


 Азот
Азот Фосфор
Фосфор Молекула фосфора
Молекула фосфора  Молекула азота
Молекула азота  Атом азота
Атом азота Атом фосфора
Атом фосфора
 Молекула аммиака
Молекула аммиака
 Мочевина
Мочевина Перевозка аммиака
Перевозка аммиака
 Азотное удобрение
Азотное удобрение
 Прибор для измерения нитратов.
Прибор для измерения нитратов.