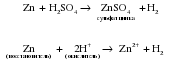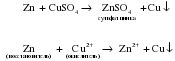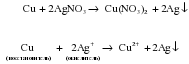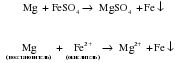Металлы побочных подгрупп
Строение атома
Разнообразие форм и свойств соединений металлов побочных подгрупп определяется, в первую очередь, значительным различием в количестве валентных электронов в их атомах. Так, в атоме скандия имеется три валентных электрона; в атоме титана – четыре; ванадия – пять; хрома – шесть: марганца – семь. Напомним, валентными электронами в атомах 3d-элементов являются электроны 3d- и 4s-подуровней. Например, в атоме марганца, как и у его предшественника хрома, 3d-подуровень заполнен ровно наполовину, то есть в основном состоянии атомов Mn и Cr имеется по пять неспаренных валентных d-электронов. В образовании химических связей участвуют также электроны 4s-подуровня атомов хрома и марганца. В атоме хрома один такой электрон, в атоме марганца – два. Таким образом, в основном состоянии у атома хрома имеется шесть неспаренных электронов, высшая степень окисления хрома +6. В возбужденном состоянии атома марганца один из 4s-электронов переходит на 4p-подуровень, образуется электронная конфигурация с семью неспаренными электронами. В итоге, высшая степень окисления марганца равна +7.
В атомах последующих 3d-элементов – железа, кобальта, никеля, меди и цинка – происходит дальнейшее заполнение d-подуровня, при этом высшая степень окисления указанных элементов всегда меньше, чем суммарное число электронов на 4s- и 3d-подуровнях. Поэтому наиболее характерные степени окисления для никеля меди и цинка лишь +2; для железа и кобальта +2 и +3. Это можно объяснить тем, что с увеличением атомного номера увеличивается заряд ядер, уменьшается радиус атомов, электроны удерживаются прочнее. Например, у цинка, десятого d-элемента, проявляющего только степень окисления +2, d-электроны заполненного подуровня уже не являются валентными.
Среди 3d-элементов только первый и последний представители – скандий и цинк – проявляют в соединениях постоянную степень окисления: скандий +3, цинк +2. Все остальные 3d-элементы являются поливалентными. В таблице приведены степени окисления 3d-элементов в образуемых ими соединениях и характер соответствующих гидроксидов.
Получение железа.
Железо восстанавливают из оксидов в доменной печи, в которую слоями засыпают железную руду и кокс. Печь снизу продувают горячим воздухом. При этом углерод кокса, частично окисляясь, образует оксид углерода(II).
Восстановленное расплавленное железо собирается в нижней части печи, где температура достигает 1800 оС. В условиях доменного процесса в присутствии кокса расплав железа растворяет углерод. Образуется сплав, содержащий до 4,3 % углерода. Этот сплав называется чугун. Чугун содержит также кремний (1,25 – 4 %), серу и фосфор (менее 1 %). Чугун используется для получения различных металлоизделий, в основном, методом литья. Но основная масса чугуна используется для передела в сталь – важнейший сплав железа, основной конструкционный материал для машиностроения.
Основная цель процесса передела чугуна в сталь – снижение содержания углерода (до 0,1 – 1,7 %), а также таких примесей, как кремний (до 0,6 %), фосфор и сера (до 0,05 %). Процесс осуществляют в конвертерах и мартеновских печах.
Конвертер для получения стали представляет собой грушевидный сосуд, облицованный изнутри огнеупорным кирпичом. В него загружают жидкий чугун, который затем продувают кислородом. При этом углерод, кремний, фосфор, сера окисляются до CO2, SiO2, P2O5, SO2. Оксиды углерода и серы улетучиваются, оксиды кремния и фосфора взаимодействуют с известняком, входящим в состав облицовки конвертера:
CaСO3 + SiO2 = CaSiO3 + СО2;
3CaСO3 + P2O5 = Ca3(PO4)2 + 3СО2.
Продукты превращений примесей образуют жидкий слой шлака над поверхностью расплавленной стали.
В мартеновскую печь можно загружать твердый чугун и металлический лом. Для связывания примесей в шлак добавляют флюс, в основном, на основе известняка. Печь нагревают газовым пламенем. Существуют также электрические печи для выплавки стали.
Ежегодно в мире производится примерно 700 млн. тонн сплавов на основе железа. Они используются как основные конструкционные материалы в машиностроении.
Производство других металлов осуществляется в гораздо меньших масштабах.
Интересно, что при получении железа основным восстановителем является не углерод, а оксид углерода(II), который образуется в печи за счет частичного окисления кокса, для чего печь продувают воздухом:
2С + О2 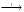 2СО;
2СО;
С + СО2 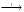 2СО.
2СО.
Затем оксид углерода(II) восстанавливает металл:
Fe2O3 + 3CO = 2Fe + 3CO2.
Химические свойства
Железо – металл. Атомы железа легко отдают электроны:
взаимодействие железа с серой:
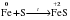 ;
;
растворение железа в соляной кислоте:
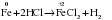 .
.
В приведенных реакциях степень окисления железа повышается от “0” до “+2”.
Железо при обычных условиях не реагирует с водой. В этом легко убедиться, если опустить в воду железный гвоздь. Однако при действии водяного пара на раскаленное железо образуются оксид железа(II,III) и водород:

Очевидно, что гидроксид железа в таких условиях образоваться не может, поскольку он разлагается при нагревании на оксид железа и воду.
Для многих металлов характерно взаимодействие с кислотами.
С растворами кислот реагируют металлы, расположенные в ряду активности перед водородом. При этом протекают окислительно-восстановительные реакции: ионы водорода выступают в роли окислителя, а металл является восстановителем. В результате образуется соль и водород:
![]()
![]()

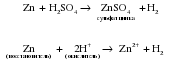
2e
Металлы, расположенные в ряду активности за водородом, с кислотами не реагируют!
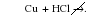
Активные металлы вытесняют менее активные металлы из растворов солей:
![]()
![]()

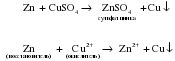
2e
Как и в случае взаимодействия металлов с кислотами, данная реакция является окислительно-восстановительной. В роли окислителя выступают ионы металла, входящего в состав соли (Cu2+), а простое вещество (Zn) является восстановителем. Так как окислительная способность ионов металлов увеличивается в ряду активности слева направо, то ионы Cu2+ (находятся правее) могут окислять Zn, но не наоборот!
Чаще всего па практике металлами средней активности (Mg, Al, Zn, Fe) восстанавливают из солей малоактивные металлы (Cu, Ag и др.). Однако можно использовать и другие комбинации. Например, восстановить ионы серебра медью, или ионы Fe2+ магнием:
![]()
![]()

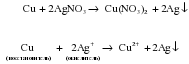
2e
![]()
![]()

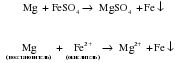
2e


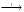 2СО;
2СО;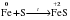 ;
;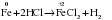 .
.