Вводное занятие. Основные понятия и расчеты в химии.
На этом занятии будет проведен анализ ЕГЭ за 2016 год, и рассказано о наших планах на 2016-2017 год.
Конспект занятия "Вводное занятие. Основные понятия и расчеты в химии."
СНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
Предмет химии
Мы живем в мире, состоящем из веществ. Это земля, вода, воздух, живые организмы, в том числе мы с вами, наша пища, предметы домашнего обихода и т. д.
Вещества могут претерпевать изменения, превращаясь из одних в другие. При этом образуются новые вещества, обладающие составом и свойствами, отличными от первоначальных. Изучение веществ и явлений, в результате которых одни вещества превращаются в другие, составляет предмет химии.

Химия – наука, изучающая вещества и их превращения.

Вещество – вид материи, обладающей массой покоя и образующей физические тела.

Химическое вещество – устойчивая совокупность частиц (атомов, молекул, ионов) обладающая определенными химическими и физическими свойствами.
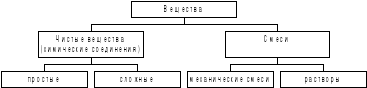
Химические соединения. Чистые вещества и смеси.
Простые и сложные вещества
Атомы являются основой всех веществ, но, как это ни парадоксально, при обычных условиях атомы большинства химических элементов в свободном виде существовать не могут. В виде отдельных атомов при обычных условиях существуют только благородные газы (гелий, неон, аргон, криптон, ксенон и радон). В остальных случаях атомы связываются друг с другом посредством химических связей и образуют химические соединения.
Химические соединения следует рассматривать как продукты взаимодействия атомов, а не просто их смешивания. В результате этого взаимодействия полученное соединение приобретает определенный состав и свойства, кроме этого, процесс может сопровождаться другими явлениями – выделением или поглощением теплоты, излучением света, взрывом.

Химическое соединение – совокупность атомов, химически связанных между собой в определенном соотношении.
Химические соединения являются основой чистых веществ и смесей.
Чистые вещества состоят из одного химического соединения, смеси – из нескольких.
Исключением являются благородные газы, так как соответствующие им чистые вещества представляют собой не химические соединения, а совокупность атомов, не связанных химическими связями.
Понятие “чистое вещество” несколько условно, так как абсолютно чистых веществ не бывает, все они содержат то или иное количество примесей. Иногда количество примесей столь мало (малые доли процента), что оно не влияет на свойства вещества и не учитывается в химических расчетах.
Смеси состоят из двух и более чистых веществ (компонентов). При смешивании компонентов может происходить обычное распределение частиц одного вещества между частицами другого без их взаимодействия, в этом случае образуется механическая смесь. Компоненты механической смеси сохраняют свойства исходных веществ, например, смесь песка и сахара.
Однако смешивание веществ может привести к продукту, обладающему другими свойствами – агрегатным состоянием, электропроводностью и др. Такая смесь называется раствором.
 Раствор – однородная смесь, состав которой может в определенных пределах непрерывно изменяться, а свойства отличаются от свойств исходных компонентов.
Раствор – однородная смесь, состав которой может в определенных пределах непрерывно изменяться, а свойства отличаются от свойств исходных компонентов.

 Пример
Пример
Водный раствор поваренной соли
Свойства водного раствора поваренной соли отличаются от свойств исходного твердого NaCl агрегатным состоянием, от воды – температурой кипения, высокой электропроводностью.
Отличие свойств раствора от свойств составляющих его компонентов является следствием физико-химического взаимодействия между растворителем и растворенным веществом. Это взаимодействие имеет достаточно сложную природу и включает распределение растворенного вещества во всем объеме растворителя (физический процесс), а также химическое взаимодействие между компонентами (ассоциация частиц растворителя и растворенного вещества, образование водородных связей, электролитическая диссоциация электролитов и др.). Наличие химического взаимодействия роднит растворы с химическими соединениями, но, в отличие от химических соединений, имеющих определенный состав, растворы могут существовать в широком интервале соотношений компонентов.
Смеси веществ могут быть разделены физическими либо химическими методами. Чтобы разделить механическую смесь жидкого и твердого веществ (воды и песка) используют фильтрование (физический процесс). Механические смеси из двух веществ в одинаковом агрегатном состоянии можно разделить после растворения одного из них и последующего фильтрования (смесь сахара и песка). Если оба вещества растворимы, процедура значительно усложняется, необходимо подбирать растворители для избирательного растворения и другие методы. Из смесей жидких веществ, а также из растворов можно выделять жидкие компоненты с помощью перегонки (перегонка нефти – физический процесс). Существуют и более сложные, в том числе химические методы разделения смесей. Следует отметить, что чем ближе по свойствам компоненты смеси, тем труднее ее разделить.
Химические соединения, являющиеся основой химических веществ, могут состоять из атомов одного либо нескольких элементов, в зависимости от этого различают простые и сложные вещества.

Вещества, которые состоят из атомов одного элемента, называются простыми, а состоящие из атомов разных элементов – сложными.
Химическими соединениями могут быть как простые (N2, S8, металлы), так и сложные (Н2О, СН4) вещества.

 Примеры
Примеры
Простые вещества: Н2 (водород), Не (гелий), Р4 (белый фосфор). Ag (серебро).
Сложные вещества: HCl (хлороводород), NaOH (гидроксид натрия), С2Н5ОН (этанол).
Атомы одного элемента могут образовывать несколько простых веществ, которые называются аллотропными модификациями.

Аллотрóпия – существование химического элемента в виде нескольких простых веществ (аллотропных модификаций).

Пример. Аллотропные модификации элементов:
углерода – алмаз, графит, карбин, фуллерит;
фосфора – белый (Р4) и красный фосфор;
кислорода – кислород (О2) и озон (О3).
С другой стороны, некоторые элементы образуют только одно простое вещество и не имеют аллотропных модификаций (кремний, азот, галогены).
Поскольку для обозначения многих простых веществ используется химический символ элемента, следует четко различать понятия “простое вещество” и “химический элемент”.
В итоге общую классификацию веществ можно представить следующей схемой:
Закон постоянства состава. Молекула.
Молекулярное и немолекулярное строение вещества.
Формульная единица
Закон постоянства состава был сформулирован в XIX веке французским ученым Жозефом Прустом. Его современная формулировка:

Чистое вещество, независимо от метода его получения, имеет одинаковый качественный и количественный состав.
Пример
Оксид углерода(IV) можно получить несколькими способами.
 Сжиганием органических веществ в кислороде:
Сжиганием органических веществ в кислороде:
CН4 + 2О2 ® СО2 + 2Н2О.
Разложением карбоната кальция:
t
СаСО3 ® СаО + СО2.
Углекислый газ, полученный обоими методами, имеет одинаковые физические и химические свойства. При достаточной чистоте исходных веществ образцы СО2, полученные в результате этих реакций, различить практически невозможно.
Выполнение закона постоянства состава должно быть обусловлено одинаковым составом и строением простейших структур, образовавшихся в результате химического взаимодействия атомов. Эти структуры называются молекулами.

Молекула – наименьшая частица вещества, способная существовать самостоятельно и сохраняющая его химические свойства.
Многие вещества состоят из молекул. Укажем вещества молекулярного строения для всех агрегатных состояний (при обычных условиях).
Все газообразные вещества. Не являются исключением благородные газы. Атомы, из которых состоят их простые вещества, называются одноатомными молекулами.
Большинство жидкостей. Исключением являются жидкие металлы, например, ртуть.
Среди твердых веществ молекулярное строение характерно для органических соединений (фенол С6Н5ОН, глюкоза С6Н12О6).
Для твердых неорганических веществ молекулярное строение нехарактерно. Его имеют некоторые простые вещества неметаллов и их соединения.

Примеры. Твердые неорганические соединения молекулярного строения
Простые вещества:
Белый фосфор Р4; сера S8; иод I2.
Сложные вещества:
Оксид фосфора(V) Р4О10; ортофосфорная кислота Н3РО4 (tпл. = 42 0С); межгалогенные соединения: хлорид иода ICl, бромид иода IBr; оксотрибромид фосфора POBr3.
Число сложных неорганических веществ молекулярного строения, твердых при обычных условиях, сравнительно невелико. В таком случае, что же собой представляет большинство неорганических веществ?
Масса атома. Относительная атомная масса.
Количество вещества. Моль. Молярная масса
Как было сказано выше, все вещества состоят из атомов. Поскольку атомы имеют массу, измерить их количество в определенной порции вещества удобнее всего с помощью взвешивания. Поэтому проблема определения массы атомов является весьма актуальной в химии.
В предыдущих разделах массу атома мы характеризовали с помощью массового числа – суммы чисел протонов и нейтронов в его ядре. Для конкретного нуклида массовое число имеет целочисленное значение, что весьма удобно. Но на самом деле массовое число не является массой данного атома, а только ее относительной характеристикой. Попытаемся определить массы атомов в единицах, используемых для измерения массы.
Реальные массы атомов соизмеримы с массами элементарных частиц и чрезвычайно малы (10–25 – 10–27 кг). Так, масса атома 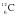 равна 1,99×10–26 кг, атома
равна 1,99×10–26 кг, атома 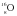 – 2,66×10–26 кг. На практике такие значения масс невозможно измерить с помощью взвешивания, кроме того, пользоваться ими в расчетах неудобно, поэтому измерять массы атомов непосредственно в единицах СИ – килограммах – на практике не принято.
– 2,66×10–26 кг. На практике такие значения масс невозможно измерить с помощью взвешивания, кроме того, пользоваться ими в расчетах неудобно, поэтому измерять массы атомов непосредственно в единицах СИ – килограммах – на практике не принято.
Поскольку единица массы СИ (килограмм) для атомов слишком велика, для измерения очень маленьких значений массы предложена атомная единица массы – а. е. м. Одна атомная единица массы составляет 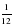 часть массы атома углерода
часть массы атома углерода 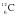 :
:
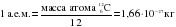
Атомную единицу массы обозначают латинской буквой u (англ. unit – единица). Если выразить в атомных единицах массу атома 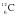 , она составит 12 u или 12 а. е. м.
, она составит 12 u или 12 а. е. м.
Нуклид 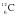 является единственным, для которого значение массы, выраженное в а. е. м., является целочисленным, поскольку это следует из самого определения атомной единицы массы. Массы других нуклидов, выраженные в а. е. м., несколько отличаются от целочисленных. Одной из причин этого является дефект массы (см. параграф 3). Так, масса нуклида
является единственным, для которого значение массы, выраженное в а. е. м., является целочисленным, поскольку это следует из самого определения атомной единицы массы. Массы других нуклидов, выраженные в а. е. м., несколько отличаются от целочисленных. Одной из причин этого является дефект массы (см. параграф 3). Так, масса нуклида 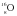 равна не 16, а 15,994915 а. е. м. Как видно, отклонение массы от целого значения невелико, поэтому в обычных расчетах используются округленные значения.
равна не 16, а 15,994915 а. е. м. Как видно, отклонение массы от целого значения невелико, поэтому в обычных расчетах используются округленные значения.
Значения атомных масс, выраженные в а. е. м. использовать удобнее, чем массы, выраженные в килограммах, но а. е. м. не является единицей СИ, и массы атомов, выраженные в а. е. м. не могут быть использованы в физических расчетах без соответствующего преобразования в единицы СИ.
Еще одним методом выражения масс атомов является относительная атомная масса – величина, показывающая, во сколько раз масса атома больше 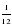 массы нуклида
массы нуклида 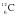 . Она обозначается Аr. Индекс r – от английского слова relative – относительный:
. Она обозначается Аr. Индекс r – от английского слова relative – относительный:
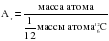
Относительная атомная масса является безразмерной величиной (для ее нахождения массу атома в кг делят на 1/12 часть массы атома 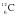 , выраженную также в кг).
, выраженную также в кг).
Значения относительных атомных масс и масс атомов, выраженных в атомных единицах массы, численно совпадают.
Относительная атомная масса элемента показывает, во сколько раз средняя масса его атомов, вычисленная с учетом распространенности изотопов данного химического элемента в природе, больше 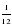 массы нуклида
массы нуклида 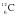 . Поэтому величины относительных атомных масс, приведенные в периодической таблице, могут заметно отклоняться от целых значений.
. Поэтому величины относительных атомных масс, приведенные в периодической таблице, могут заметно отклоняться от целых значений.
Таким образом, целочисленной является только относительная атомная масса нуклида 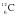 . В то же время относительная атомная масса углерода, приведенная в периодической системе химических элементов, составляет 12,011, так как природный углерод содержит 1,108 % нуклида
. В то же время относительная атомная масса углерода, приведенная в периодической системе химических элементов, составляет 12,011, так как природный углерод содержит 1,108 % нуклида 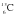 с массовым числом, равным 13.
с массовым числом, равным 13.
Для молекул, массы которых соизмеримы с массами атомов, используется относительная молекулярная масса, равная сумме относительных атомных масс элементов, составляющих данную молекулу с учетом числа атомов каждого элемента в молекуле:
Мr(H2O) = 2Ar(H) + Ar(O) = 2 + 16 = 18.
Обобщим вышеизложенное. Массовое число не является массой атома, а только суммой чисел протонов и нейтронов, составляющих его. Массы отдельных атомов могут быть выражены в единицах СИ, но эти значения слишком малы и неудобны для использования. Более удобно использовать атомные единицы массы (а. е. м.) либо относительную атомную массу, при этом массы атомов имеют значения от единиц до сотен, которые намного проще использовать в расчетах. Однако а. е. м. не является единицей СИ, а относительная атомная масса – тем более, так как представляет собой безразмерную величину.
Как видно, проблема измерения атомных масс оказывается запутанной и трудноразрешимой, если ограничиться понятием массы отдельного атома. Значения, которые ее отражают, неудобно представлять в единицах СИ и использовать для подстановки в соответствующие расчетные формулы без предварительного преобразования. Проблему можно решить, если перейти от измерения масс единичных чрезвычайно малых объектов (атомов, молекул) к измерению масс их значительных количеств. Это можно сделать, используя физическую величину количество вещества.

Количество вещества – физическая величина, характеризующая число структурных единиц (атомов, молекул, формульных единиц) в определенной порции вещества
В химии количество вещества называют также химическим количеством вещества.
Количество вещества является одной из семи основных физических величин, на которых базируется Международная система СИ, наряду с длиной, массой, временем, силой электрического тока, термодинамической температурой и интенсивностью света. Все остальные физические величины являются производными семи основных. Единица количества вещества – моль.
Один моль вещества содержит столько структурных единиц, сколько атомов содержит 0,012 кг (12 г) углерода 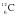 . Это число называется постоянной Авогадро NA. Численное значение и размерность постоянной Авогадро:
. Это число называется постоянной Авогадро NA. Численное значение и размерность постоянной Авогадро:
NA = 6,02 ×1023 моль-1

Один моль вещества содержит 6,02×1023 структурных единиц (атомов, молекул, формульных единиц).
Это число настолько огромно, что использовать количество вещества и его единицу моль для измерения числа объектов, непосредственно воспринимаемых нами, неудобно и бессмысленно. Например, может ли существовать моль газет? Попробуем оценить это. Тиражи крупнейших газет составляют величины порядка 106 экземпляров. Это всего лишь 10-17 часть одного моля, то есть необходимо издать 1017 миллионных тиражей, чтобы получить один моль газет. Это, конечно, невозможно. Получается, что измерять число объектов макромира в молях так же неудобно, как и массу объектов микромира в килограммах. То есть для описания объектов, имеющих размеры и массы различного масштаба, необходимы принципиально разные подходы. Большие объекты можно рассматривать по отдельности, микрочастицы (атомы и т. д.) – большими группами с числом частиц в этих группах, соизмеримым с постоянной Авогадро.
Количество вещества обозначается латинской буквой n, единица его измерения – моль. Масса 1 моль вещества называется молярной массой. Обычно молярная масса выражается в граммах на моль (г/моль), при необходимости легко перейти к кг/моль.
1 г/моль = 10-3 кг/моль.
Молярная масса веществ молекулярного строения является массой 6,02×1023 молекул, то есть одного моля молекул. Для веществ немолекулярного строения молярная масса равна массе 1 моль формульных единиц вещества. В молях можно измерять не только число атомов, молекул, формульных единиц, но и ионов, радикалов, атомных групп.
На рисунке изображены емкости, содержащие по одному молю хорошо известных веществ. На первый взгляд кажется, что это совершенно произвольные порции, но их объединяет одно – в каждой содержится по 1 молю молекул воды, серной кислоты, сахарозы и формульных единиц хлорида натрия.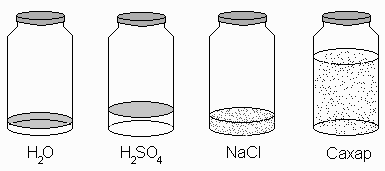
Массу (m), молярную массу (M) и количество вещества (n) связывают между собой следующие формулы:

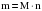 ;
; 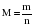 ;
; 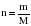 .
.
Пример
 Сколько атомов каждого из элементов содержится в 27,0 г воды?
Сколько атомов каждого из элементов содержится в 27,0 г воды?
Сначала вычислим количество вещества Н2О в 27 г воды:

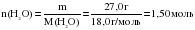
В одной молекуле воды содержится 1 атом кислорода и 2 атома водорода, следовательно:
n(O) = n(H2O) = 1,50 моль;
n(H) = 2n(H2О) = 3,00 моль.
Отсюда легко вычислить число соответствующих частиц, умножив количество вещества на постоянную Авогадро:
N(атомов О) = 6,02×1023 × 1,50 = 9,03×1023;
N(атомов Н) = 6,02×1023 × 3,00 = 18,06×1023.
12
Конспект занятия "Вводное занятие. Основные понятия и расчеты в химии."
Подготовка к ЕГЭ.
Занятие 1. Основные понятия и расчеты в химии.
Задание 1
Рассчитайте число молекул в следующих порциях веществ:
а) 12,0г кислорода;
б) 1000см3 (н.у.) метана;
в) 7,0дм3 (н.у.) азота;
г) 30г воды.
Задание 2
Рассчитайте объёмы следующих порций веществ:
а) 2,3г оксида азота (IV);
б) 11г углекислого газа;
в) 1,5 моль аммиака;
г) 3,01•1024 молекул кислорода.
Задание 3
В порции хлорида магния содержится 12,061023 ионов магния. Определите массу (г) такой порции хлорида магния.
Задание 4
Смесь состоит из Na2SO4 химическим количеством 2,45 моль и Al2(SO4)3 химическим количеством 0,55 моль. Какое число атомов кислорода содержится в этой смеси?
Задание 5
Вычислите массовую долю (%) углерода в уксусной кислоте СН3COOH.
Задание 6
Определите массовую долю (%) воды в кристаллогидрате фосфата цинка Zn3(PO4)2×4H2O.
Задание 7
Рассчитайте мольную долю (%) атомов:
а) кислорода в фосфорной кислоте;
б) азота в нитрате аммония;
в) фосфора в дигидрофосфате кальция.
Задание 8
Какую массу (г) железа можно получить из:
а) 2,3г оксида железа (III);
б) 5,3г Fe(NO3)3•7Н2O;
в) 4,8г магнетита Fe3O4 ?
Задание 9
Рассчитайте массу (в г) порций веществ:
а) серной кислоты;
б) гидрокарбоната натрия,
если масса атомов водорода в них равна 5,6г.
| Задание 10 Установите соответствие между химическим элементом и общей формулой его высшего гидроксида. |
|
|
|
|
Задание 11 Вещество, при диссоциации которого образуются катионы Na+, H+, а также анионы SO42-, является: | ||||||||||||
|
Задание 12
Соединение состава К2ЭО2 может быть получено в результате реакций:
1) Zn(OH)2 + KOH →;
2) ZnO + KOH + H2O→;
3) Al2O3 + KOH + H2O→;
4) ZnO + KOH→.
|
Задание 13 Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать. |
|
|
|
Задание 14
Оксид углерода (IV) является продуктом реакций, схемы которых:
1) Na2CO3 (ТВ) + SiO2 (ТВ)→;
2) NaHCO3 (р-р) + NaOH (р-р)→;
3) Ca(HCO3)2→;
4) NaHCO3 + HCl→.
Задание 15
| Установите соответствие между уравнением реакции и формулой вещества, которое в данной реакции является окислителем. |
|
|
|
Задание 16
Натрий нагрели в атмосфере водорода. При добавлении к полученному веществу воды наблюдали выделение газа и образование прозрачного раствора. Через этот раствор пропустили бурый газ, который был получен
в результате взаимодействия меди с концентрированным раствором азотной кислоты. Напишите уравнения четырёх описанных реакций.
Задание 17
Используя метод электронного баланса, составьте уравнение реакции:
Si + HNO3 + HF → H2SiF6 + NO + … .
Определите окислитель и восстановитель.
Задание 18
Какую массу (г) гидроксида натрия нужно растворить в 500 мл 10%-ного раствора гидроксида натрия (плотность 1,1 г/мл), чтобы получить 25%-ный раствор щелочи ?
Задание 19
В 400 г 5%-ного раствора гидроксида натрия добавили 0,92 г натрия. Вычислите массовую долю (%) щелочи в полученном растворе. (Ответ округлите с точностью до десятых)
Задание 20
Техническую поваренную соль массой 200 г обработали избытком концентрированной серной кислоты. Определите массовую долю (%) примесей в соли, если при выходе 95% выделилось 64,59 л (н.у.) газа. (Ответ запишите числом с точностью до десятых.)
Задание 21
Оксид углерода (IV), полученный при сжигании угля массой 50 г, пропущен через раствор гидроксида бария. Какая масса (г) осадка образуется, если массовая доля углерода в угле составляет 96% ?
Задание 22
В результате реакции, термохимическое уравнение которой
2Н2 (газ) + О2 (газ) = 2Н2О(газ) + 484 кДж, выделилось 1479 кДж теплоты. Вычислите массу образовавшейся при этом воды (в граммах).
Задание 23
Сгорание метана протекает согласно термохимическому уравнению
СН4 + 2О2 = СО2 (г) + 2Н2О(ж) + 890 кДж. Испарение воды происходит согласно уравнению Н2О(ж) = Н2О(г) - 44 кДж. Рассчитайте минимальный объём (н.у.) метана (л), который необходимо сжечь для получения теплоты, достаточной для испарения воды объёмом 2,25 л
Задание 24
Определите массовые доли (в %) сульфата железа (II) и сульфида алюминия в смеси, если при обработке 25 г этой смеси водой выделился газ, который полностью прореагировал с 960 г 5%-ного раствора сульфата меди. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
Задание 25
При полном сгорании порции вещества массой 1,1г получено 2,2 г углекислого газа и 0,9 г воды. 0,7л (н.у.) паров вещества имеют массу 2,75. Найдите молекулярную формулу вещества. При нагревании этого вещества с гидроксидом меди (II) выпадает осадок кирпично-красного цвета.
На основании этих данных условия задания:
а) произведите вычисления, необходимые для установления молекулярной формулы органического вещества;
б) запишите молекулярную исходного органического вещества;
в) составьте структурную формулу этого вещества, которая однозначно отражает порядок связи атомов в его молекуле;
г) напишите уравнение реакции этого вещества с гидроксида меди (II) при нагревании.
Задача 26
Плотность смеси метана и кислорода равна 1,250 г/л (н. у.).
а) Определите относительную плотность этой смеси по воздуху.
б) Рассчитайте объемные и массовые доли газов в смеси.
в) Исходную смесь подожгли. Рассчитайте плотность образовавшейся газообразной смеси при нормальных условиях.
Задания по теме для самостоятельного решения
Задание 1
(5 баллов)Задача 1
В порции нитрата натрия содержится 3,01×1023 атомов кислорода. Определите массу (г) такой порции нитрата натрия. Ответ округлите до десятых.
Задание 2
(5 баллов)Задача 2
Масса хлорида магния MgCl2 равна 190 г. Найдите химическое количество вещества (моль) хлорида магния.
Задание 3
(5 баллов)Задача 3
Определите число молекул углекислого газа CO2, которое содержит столько же атомов кислорода, сколько атомов содержится в 5 молекулах аммиака NH3.

