Конспект занятия "Основания."
Основания – это электролиты, образующие в результате электролитической диссоциации в качестве анионов только анионы ОН– (гидроксид-ионы). Число гидроксид-ионов, приходящихся на один катион металла, называется кислотностью основания. Соответственно, бывают однокислотные (NaOH, KOH) и многокислотные (Ca(OH)2, Fe(OH)2) основания.
Основания делятся на сильные (щелочи) и слабые. Заметные концентрации гидроксид-ионов в растворе могут создать только сильные основания – щелочи. Щелочами являются гидроксиды щелочных и щелочноземельных металлов. Наиболее часто использующиеся на практике щелочи – NaOH, KOH, Ca(OH)2, Ba(OH)2. Все остальные основания являются слабыми. Гидроксиды бериллия и магния не являются щелочами. Причем Ве(OH)2 – амфотерный гидроксид, Mg(OH)2 – слабое основание.
Все щелочи – сильные электролиты, диссоциируют полностью и необратимо:
Ва(ОН)2 Ва2+ + 2ОН–.
Диссоциация протекает по двум ступеням практически полностью.
Рассмотрим химические свойства оснований.
Общие химические свойства щелочей обусловлены наличием в их растворах гидроксид-ионов. Щелочи изменяют окраску индикаторов (фенолфталеин – малиновый; лакмус – синий; метилоранж – желтый).
В ионных уравнениях формулы щелочей следует записывать в диссоциированном виде.
Химические свойства щелочей
Взаимодействие с кислотами (реакция нейтрализации):
NaOH + HCl = NaCl + H2O
H+ + OH– = H2O.
Взаимодействие с кислотными и амфотерными оксидами:
2NaOH + SiO2 = Na2SiO3 + H2O
2OH– + SiO2 = SiO32– + H2O;
2NaOH + ZnO  Na2ZnO2 + Н2О.
Na2ZnO2 + Н2О.
Взаимодействие с амфотерными гидроксидами:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Al(OH)3 + 3OH– = [Al(OH)6]3–.
Взаимодействие с солями (реакция обмена):
FeCl3 + 3NaOH = Fe(OH)3 + 3NaCl
Fe3+ + 3OH– = Fe(OH)3.
Некоторые щелочи при нагревании разлагаются:
Ca(OH)2 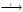 CaO + H2O;
CaO + H2O;
Ba(OH)2 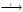 BaO + H2O;
BaO + H2O;
2LiOH 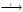 Li2O + H2O.
Li2O + H2O.
Гидроксиды натрия и калия не разлагаются при нагревании. При температурах 323 0С и 405 0С соответственно NaOH и KOH плавятся без разложения.
Слабые основания обладают очень малой растворимостью и не могут создать заметной концентрации ионов ОН–, поэтому ряд свойств, присущих щелочам для них нехарактерен. В ионных уравнениях формулы нерастворимых оснований следует записывать в недиссоциированном виде. Все это относится и к амфотерным гидроксидам.
Нерастворимые основания и амфотерные гидроксиды взаимодействуют с растворами кислот:
Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
Cu(OH)2 + 2H+ = Cu2+ + 2H2O;
Zn(OH)2 + 2HNO3 = Zn(NO3)2 + 2H2O
Zn(OH)2 + 2H+ = Zn2+ + 2H2O;
Амфотерные гидроксиды взаимодействуют с растворами щелочей:
Al(OH)3 + 3NaOH = Na3[Al(OH)6]
Al(OH)3 + 3OH– = [Al(OH)6]3–.
Кроме этого, нерастворимые основания и амфотерные гидроксиды при нагревании разлагаются на соответствующий оксид и воду:
Cu(OH)2 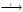 CuO + H2O;
CuO + H2O;
Zn(OH)2 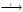 ZnO + H2O.
ZnO + H2O.



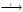 CaO + H
CaO + H