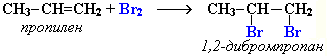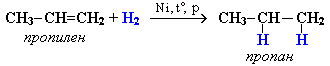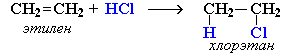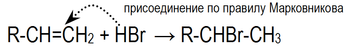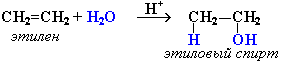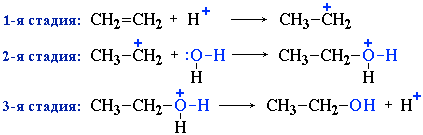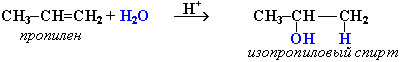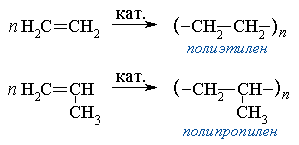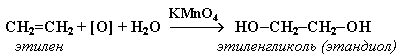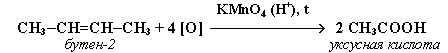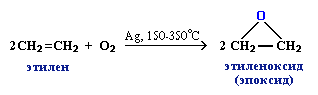Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4). По номенклатуре IUPAC названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение двойной связи указывается арабской цифрой.Углеводородные радикалы, образованные от алкенов имеют суффикс «-енил». Тривиальные названия: CH2=CH— «винил», CH2=CH—CH2—«аллил».
Алкены, число атомов углерода в которых больше двух, (т.е. кроме этилена) имеют изомеры. Для алкенов характерны изомерия углеродного скелета, положения двойной связи, межклассовая и пространственная. Например, единственным изомером пропена является циклопропан (C3H6) по межклассовой изомерии. Начиная с бутена, существуют изомеры по положению двойной связи (бутен-1 и бутен-2), по углеродному скелету (изобутилен или метилпропен) и геометрические изомеры (цис-бутен-2 и транс-бутен-2). С ростом числа атомов углерода в молекуле количество изомеров быстро возрастает.

| этен (этилен) | C2H4 |
| пропен | C3H6 |
| бутен | C4H8 |
| пентен | C5H10 |
| гексен | C6H12 |
| гептен | C7H14 |
| октен | C8H16 |
| нонен | C9H18 |
| децен | C10H20 |
Алкены могут существовать в виде пространственных или геометрических изомеров.
Различают:
цис- изомеры: заместители расположены по одну сторону от двойной связи;
транс- изомеры: заместители расположены по разные стороны от двойной связи.
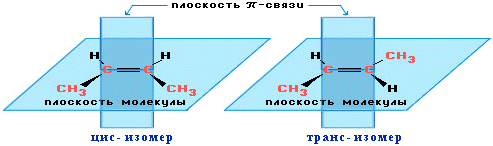
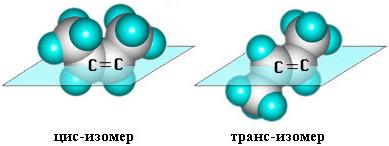
цис-транс-Изомерия не проявляется, если хотя бы один из атомов С при двойной связи имеет 2 одинаковых заместителя.
Например, бутен-1 СН2=СН–СН2–СН3 не имеет цис- и транс-изомеров, т.к. 1-й атом С связан с двумя одинаковыми атомами Н. Изомеры цис- и транс- отличаются не только физическими, но и химическими свойствами, т.к. сближение или удаление частей молекулы друг от друга в пространстве способствует или препятствует химическому взаимодействию. Иногда цис-транс-изомерию не совсем точно называют геометрической изомерией. Неточность состоит в том, что все пространственные изомеры различаются своей геометрией, а не только цис- и транс-.
Двойная связь является сочетанием σ- и π-связей (хотя она изображается двумя одинаковыми черточками, всегда следует учитывать их неравноценность). σ-Связь возникает при осевом перекрывании sp2-гибридных орбиталей, а π-связь – при боковом перекрывании р-орбиталей соседних sp2-гибридизованных атомов углерода. Образование связей в молекуле этилена можно изобразить следующей схемой:
С=С σ-связь (перекрывание 2sp2-2sp2) и π-связь (2рz-2рz)
С–Н σ-связь (перекрывание 2sp2-АО углерода и 1s-АО водорода)
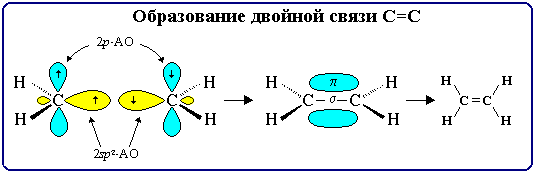
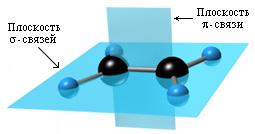
σ-Связи, образуемые sp2-гибридными орбиталями, находятся в одной плоскости под углом 120°. Поэтому молекула этилена имеет плоское строение:
Модели молекулы этилена
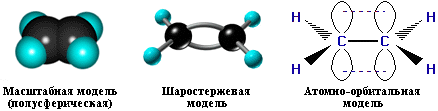
По своей природе π-связь резко отличается от σ-связи: π-связь менее прочная вследствие меньшей эффективности перекрывания р-орбиталей. Аналогичное строение имеют другие алкены.
Температуры плавления и кипения алкенов (упрощенно) увеличиваются с молекулярной массой и длиной главной углеродной цепи.
При нормальных условиях алкены с C2H4 до C4H8 — газы; с C5H10 до C17H34 — жидкости, после C18H36 — твёрдые тела. Алкены не растворяются в воде, но хорошо растворяются в органических растворителях.
| Физические свойства алкенов |
| № | Название | Формула | Т плавления,°С | Т кипения,°С | Плотность, d204 |
| 1 | Этилен | С2H4 | −169,1 | −103,7 | 0,5700* |
| 2 | Пропилен | C3H6 | −187,6 | −47,7 | 0,5193* |
| 3 | Бутен-1 | C4H8 | −185,3 | −6,3 | 0,5951* |
| 4 | цис-Бутен-2 | CH3-CH=CH-CH3 | −138,9 | 3,7 | 0,6213 |
| 5 | транс-Бутен-2 | CH3-CH=CH-CH3 | −105,5 | 0,9 | 0,6042 |
| 6 | 2-Метилпропен-1 | CH3-C(CH3)=CH2 | −140,4 | −7,0 | 0,5942* |
| 7 | Пентен-1 | С5H10 | −165,2 | 30,1 | 0,6405 |
| 8 | Гексен-1 | С6H12 | −139,8 | 63,5 | 0,6730 |
| 9 | Гептен-1 | С7H14 | −119,0 | 93,6 | 0,6970 |
| 10 | Октен-1 | С8H16 | −101,7 | 121,3 | 0,7140 |
Получение алкенов.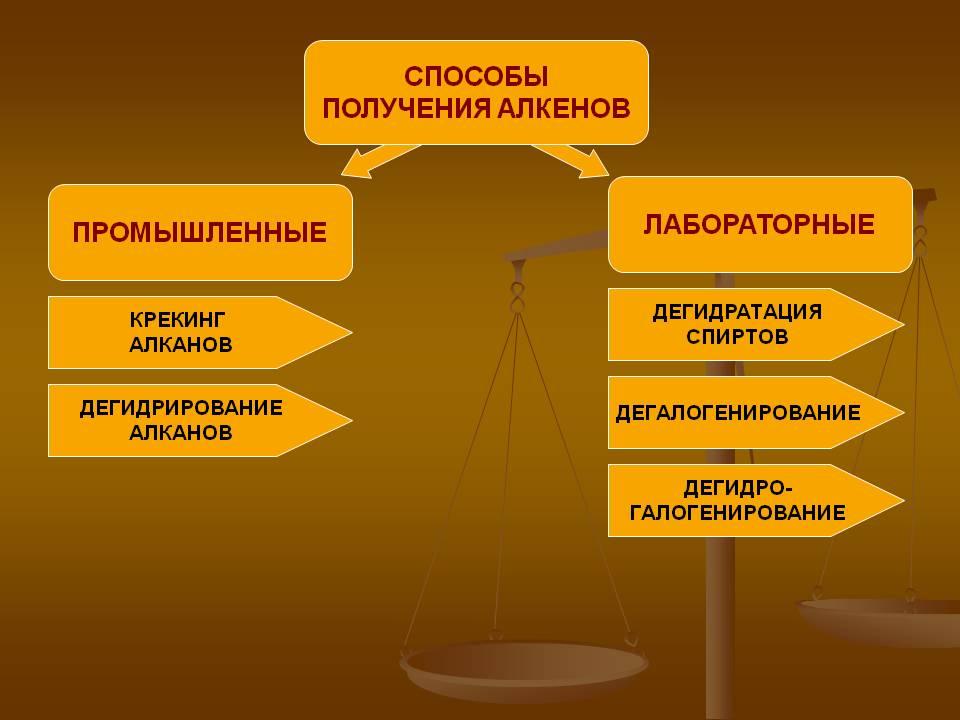
Крекинг алканов
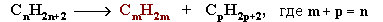
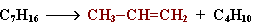
Дегидрирование алканов
Это один из промышленных способов получения алкенов. Температура: 350—450 °C, катализатор — Cr2O3. Также используются алюмомолибденовые и алюмоплатиновые катализаторы.
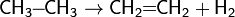
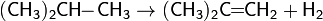
Дегидрогалогенирование и дегалогенирование алканов
Отщепление галогенов у дигалогеналканов происходит в присутствии цинка.
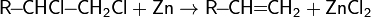
Дегидрогалогенирование проводят при нагревании действием спиртовыми растворами щелочей:
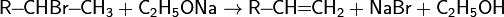
При отщеплении галогенводорода образуется смесь изомеров, преобладающий из которых определяется правилом Зайцева: отщепление протона происходит от менее гидрогенизированного атома углерода.
Дегидратация спиртов
Дегидратацию спиртов ведут при повышенной температуре в присутствии сильных минеральных кислот:
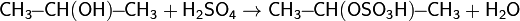

Реакции присоединения:
Присоединение галогенов по двойной связи С=С происходит легко в обычных условиях (при комнатной температуре, без катализатора). Например, быстрое обесцвечивание красно-бурой окраски раствора брома в воде (бромной воды) служит качественной реакцией на наличие двойной связи:
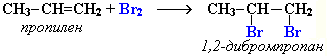
Еще легче происходит присоединение хлора:
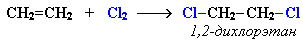
Эти реакции протекают по механизму электрофильного присоединения с гетеролитическим разрывом связей в молекуле галогена.
При нагревании до 500 °С возможно радикальное замещение атома водорода при соседнем к двойной связи атоме углерода:
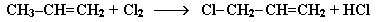
Алкены взаимодействуют с водородом при нагревании и повышенном давлении в присутствии катализаторов (Pt, Pd, Ni и др.) с образованием алканов:
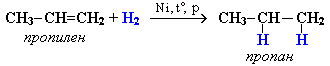
Присоединение водорода к атомам углерода в алкенах приводит к понижению степени их окисления:
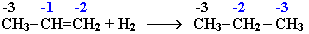
Поэтому гидрирование алкенов относят к реакциям восстановления. Эта реакция используется в промышленности для получения высокооктанового топлива.
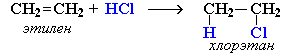
Реакция идет по механизму электрофильного присоединения с гетеролитическим разрывом связей. Электрофилом является протон Н+ в составе молекулы галогеноводорода HX (X - галоген).
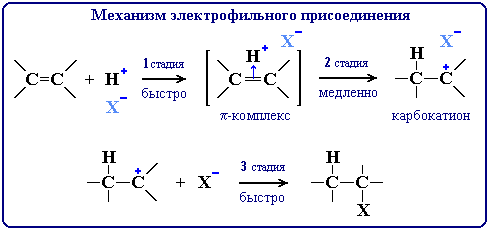
Энергетическая диаграмма реакции
Направление реакции присоединения галогеноводородов к алкенам несимметричного строения (например, к пропиленуCH2=CH–СН3) определяется правилом Марковникова: в реакциях присоединения полярных молекул типа НХ к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи (т.е. атому углерода, связанному с наибольшим числом атомов водорода).
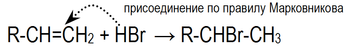
Эта закономерность была первоначально установлена эмпирически. В современной органической химии дано теоретическоеобоснование правила Марковникова на основе положения о влиянии электронного строения молекул на их реакционную способность.Следует отметить, что правило Марковникова в его классической формулировке соблюдается только для электрофильных реакций самих алкенов. В случае некоторых производных алкенов или при изменении механизма реакции идут против правила Марковникова.
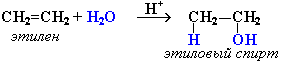
Гидратация происходит в присутствии минеральных кислот по механизму электрофильного присоединения: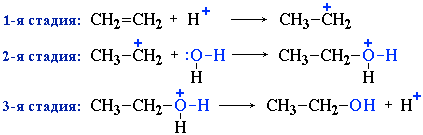
В реакциях несимметричных алкенов соблюдается правило Марковникова.
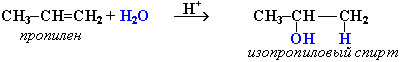
1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
n M  Mn
Mn
Число n в формуле полимера (Mn) называется степенью полимеризации. Реакции полимеризации алкенов идут за счёт присоединения по кратным связям:
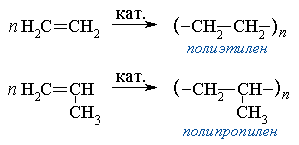
Реакции окисления алкенов:
Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя.
1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакцияВагнера):
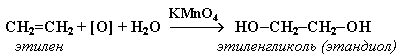
Полное уравнение реакции:
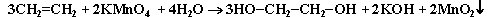
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
2. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
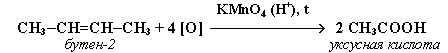
3. Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе:
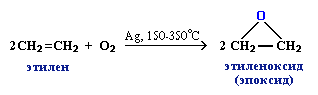
4. Полное окисление (горение):
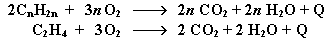
Газообразные гомологи алкенов образуют с воздухом взрывоопасные смеси.
Промышленное использование этилена:
Этилен используется для производства целого ряда химических соединений: винилхлорида, стирола, этиленгликоля, этиленоксида, этаноламинов, этанола, диоксана, дихлорэтана,уксусного альдегида и уксусной кислоты. Полимеризацией этилена и его прямых производных получают полиэтилен, поливинилацетат, поливинилхлорид, каучуки и смазочные масла.
Мировое производство этилена составляет порядка 100 млн тонн в год (по данным на 2005 год: 107 млн тонн).
Промышленное использование пропилена:
Пропилен в промышленности применяется, в основном, для синтеза полипропилена (62 % процента всего выпускаемого объема). Также из него получают кумол, окись пропилена, акрилонитрил, изопропанол, глицерин, масляный альдегид.
В настоящее время мировые мощности по выпуску пропилена составляют около 70 млн тонн в год.