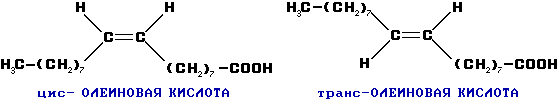Содержание
Номенклатура
Карбоновые кислотные остатки
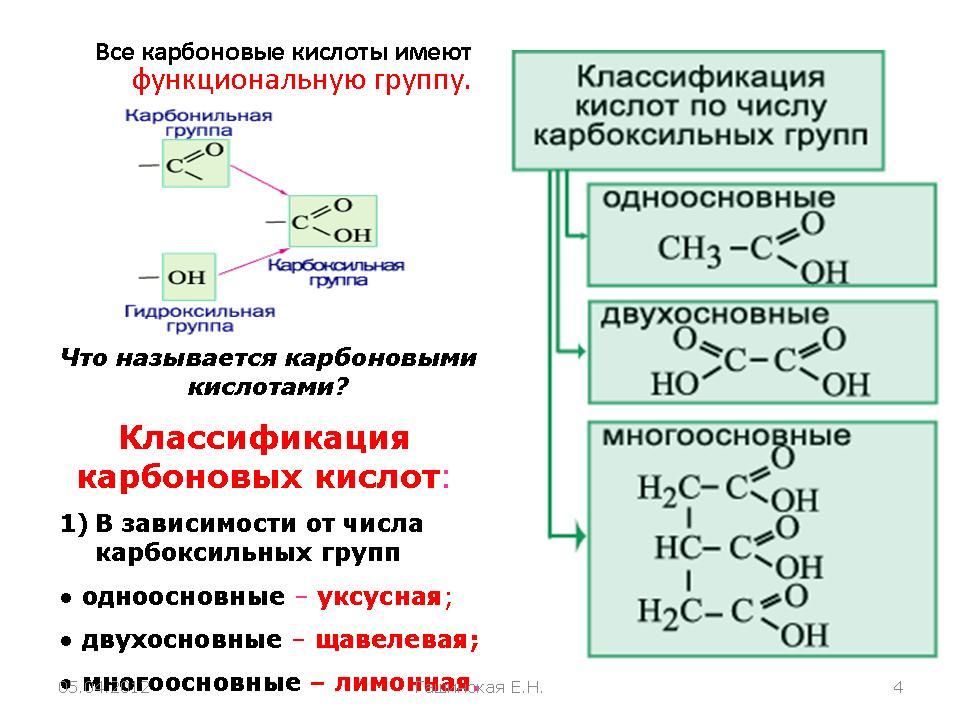
Классификация
Применение
Получение
Физические свойства
Характерные химические реакции
Литература
Приложения
Практические задачи по теме: «Карбоновые кислоты»
Видео по теме: «Карбоновые кислоты»
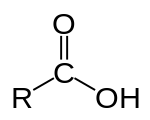
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH. Кислые свойства объясняются тем, что данная группа может сравнительно легко отщеплять протон. За редкими исключениями карбоновые кислоты являются слабыми. Например, у уксусной кислоты CH3COOH константа кислотности равна 1,75·10−5. Ди- и трикарбоновые кислоты более сильные, чем монокарбоновые.
Номенклатура
По международной номенклатуре ИЮПАК, карбоновые кислот называют, выбирая за основу наиболее длинную углеродную цепочку, содержащую группу -СООН, и добавляя к названию соответствующего углеводорода окончание "овая" и слово "кислота". При этом атому углерода, входящему в состав карбоксильной группы, присваивается первый номер. Например СН3-СН2-СООН - пропановая кислота, СН3-С(СН3)2-СООН - 2,2-диметилпропановая кислота.
По рациональной номенклатуре к названию углеводорода добавляют окончание "карбоновая" и слово "кислота", не включая при этом в нумерацию цепи атом углерода карбоксильной группы. Например, С5Н9СООН - циклопентанкарбоновая кислота, СН3-С(СН3)2-СООН - трет-бутилкарбоновая кислота.
Многие из карбоновых кислот имеют тривиальные названия (некоторые из них приведены в таблице).
Названия одноосновных карбоновых кислот
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
| Муравьиная кислота | Метановая кислота | 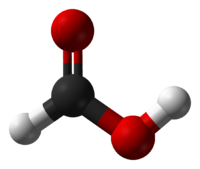 HCOOH | формиаты |
| Уксусная кислота | Этановая кислота | 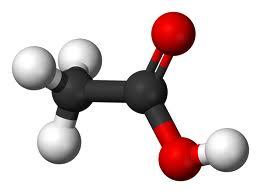 CH3COOH | ацетаты |
| Пропионовая кислота | Пропановая кислота | 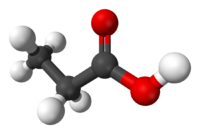 C2H5COOH | пропионаты |
| Масляная кислота | Бутановая кислота | 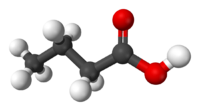 C3H7COOH | бутираты |
| Валериановая кислота | Пентановая кислота | 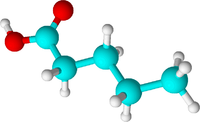 C4H9COOH | валераты |
| Капроновая кислота | Гексановая кислота | 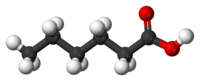 C5H11COOH | капраты |
| Энантовая кислота | Гептановая кислота | 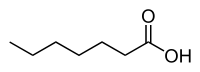 C6H13COOH | энантоаты |
| Каприловая кислота | Октановая кислота | C7H15COOH | каприлаты |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Названия двухосновных карбоновых кислот
| Тривиальное название | Название по ИЮПАК | Формула | Название солей |
| Щавелевая кислота | Этандиовая кислота | 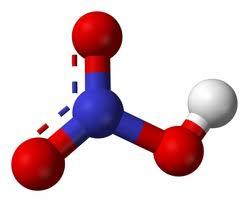
HOOCCOOH | оксалаты |
|
|
|
|
|
Классификация
В зависимости от радикала, связанного с карбоксилом, различают следующие группы карбоновых кислот:
ароматические
алифатические (в том числе предельные и непредельные)
алициклические
гетероциклические.
По числу карбоксильных групп кислоты могут быть одно-, двух- и многоосновными. При введении в молекулы кислоты других функциональных групп (например, -ОН, =CO, -NH2 и др.) образуются окси-, кето-, аминокислоты и другие классы соединений.
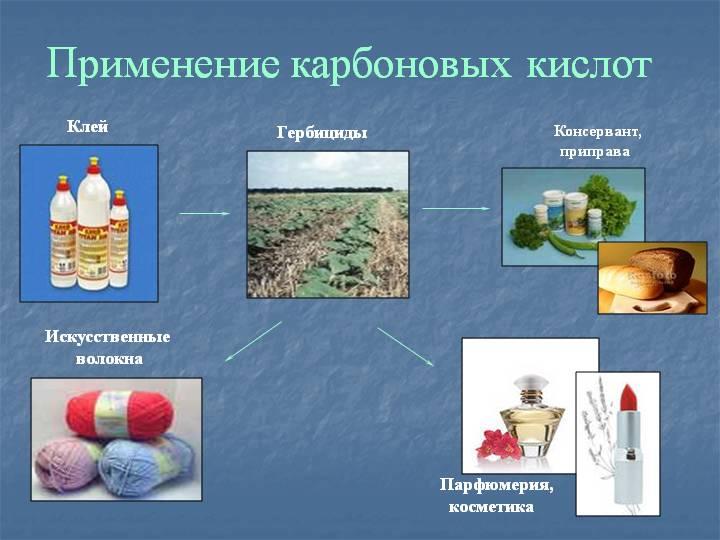
Применение
Муравьиная кислота – в медицине - муравьиный спирт (1,25% спиртовой раствор муравьиной кислоты), в пчеловодстве, в органическом синтезе, при получении растворителей и консервантов; в качестве сильного восстановителя.
Уксусная кислота – в пищевой и химической промышленности (производство ацетилцеллюлозы, из которой получают ацетатное волокно, органическое стекло, киноплёнку; для синтеза красителей, медикаментов и сложных эфиров). В домашнем хозяйстве как вкусовое и консервирующее вещество.
Масляная кислота – для получения ароматизирующих добавок, пластификаторов и флотореагентов.
Щавелевая кислота – в металлургической промышленности (удаление окалины).
Стеариновая (C17H35COOH) и пальмитиновая (C15H31COOH) кислоты _ – в качестве поверхностно-активных веществ, смазочных материалов в металлообработке.
Олеиновая кислота (C17H33COOH) – фотореагент и собиратель при обогащении руд цветных металлов.
Карбоновые кислоты - исходные соединения для получения промежуточных продуктов органического синтеза, в частности кетенов, галогенангидридов, виниловых эфиров, галогенкислот. Соли карбоновых кислот и щелочных металлов применяют как мыла, эмульгаторы, смазочные масла; соли тяжелых металлов - сиккативы, инсектициды и фунгициды, катализаторы. Эфиры кислот - пищевые добавки, растворители; моно- и диэфиры гликолей и полигликолей пластификаторы, компоненты лаков и алкидных смол; эфиры целлюлозы - компоненты лаков и пластмассы. Амиды кислот эмульгаторы и флотоагенты.
Получение
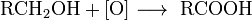
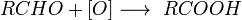
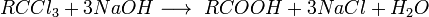

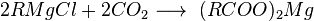
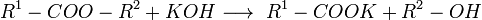
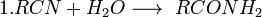
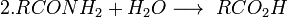
Катализируется кислотой или основанием; первоначально образуется амид, который гидролизуется до кислоты; лишь в редких случаях амид устойчив к гидролизу; удобный лабораторный метод (если нитрил доступен)
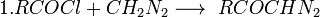
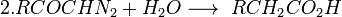
Используется для получения высших гомологов кислот из низших.

Физические свойства
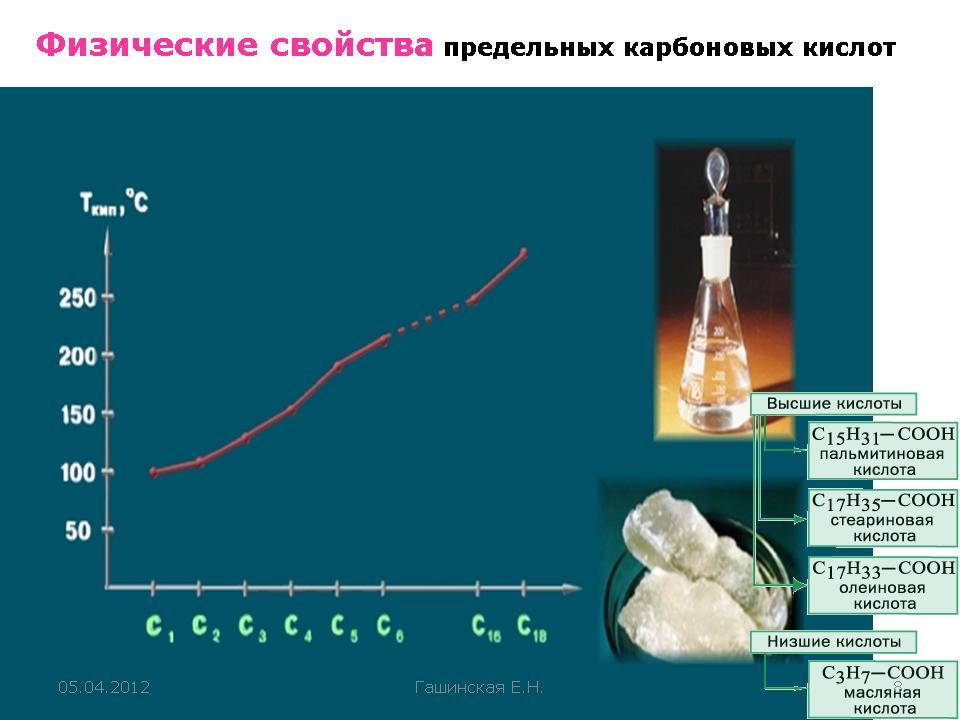
Низшие карбоновые кислоты — жидкости с острым запахом, хорошо растворимые в воде. С повышением относительной молекулярной массы растворимость кислот в воде и их плотность уменьшаются, а температура кипения повышается. Высшие кислоты, начиная с пеларгоновой (н-нонановой) СН3-(СН2)7-СООН, — твердые вещества, без запаха, нерастворимые в воде. Низшие карбоновые кислоты в безводном виде и в виде концентрированных растворов раздражают кожу и вызывают ожоги, особенно муравьиная кислота и уксусная кислота.
На физических свойствах карбоновых кислот сказывается значительная степень ассоциации вследствие образования водородных связей. Кислоты в отличие от спиртов, образуют более прочные водородные связи, вследствие того что связи  в них в большей степени поляризованы по типу
в них в большей степени поляризованы по типу 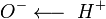 Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
Кроме того, у карбоновых кислот имеется возможность образования водородных связей с кислородом карбонильного диполя, обладающим значительной электроотрицательностью, а не только с кислородом другой гидроксильной группы. Действительно, в твердом и жидком состояниях карбоновые кислоты существуют в основном в виде циклических димеров.
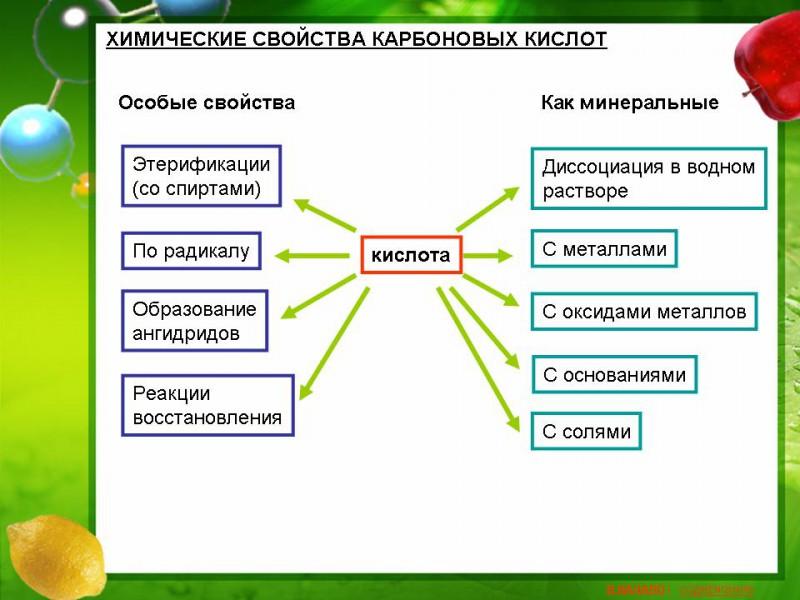
Характерные химические реакции
Наиболее важные химические свойства, характерные для большинства карбоновых кислот:
1. Карбоновые кислоты при реакции с металлами, их оксидами или их осно́вными гидроксидами дают соли соответствующих металлов:



2. Карбоновые кислоты могут вытеснять более слабую кислоту из её соли, например:

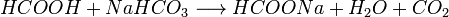
3. Карбоновые кислоты в присутствии кислого катализатора реагируют со спиртами, образуя сложные эфиры (реакция этерификации):

4. При нагревании аммонийных солей карбоновых кислот образуются их амиды:
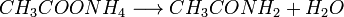
5. Под действием 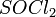 карбоновые кислоты превращаются в соответствующие хлорангидриды:
карбоновые кислоты превращаются в соответствующие хлорангидриды:
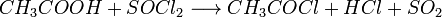
Изомерия карбоновых кислот
Cтруктурная изомерия:
изомерия скелета в углеводородном радикале (начиная с C4).
межклассовая изомерия, начиная с C2.
Например, формуле C2H4O2 соответствуют 3 изомера, относящиеся к различным классам органических соединений.
Пространственная изомерия:
Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Например:
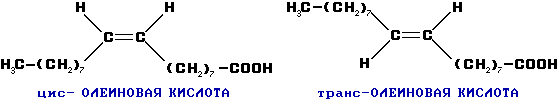
Список литературы
Общая органическая химия т. 4 под ред. Д. Бартона и Д. Оллиса. М.: Химия. 1983
Сайкс П. Механизмы реакций в органической химии. М.: Химия. 1991
Адамс М. Карбоновые кислоты в органике. М.: Химия. 1990
Дж. Роберт, М.Касерио "Основы органической химии" т. 1 Издание 2-е, дополненное. 1978