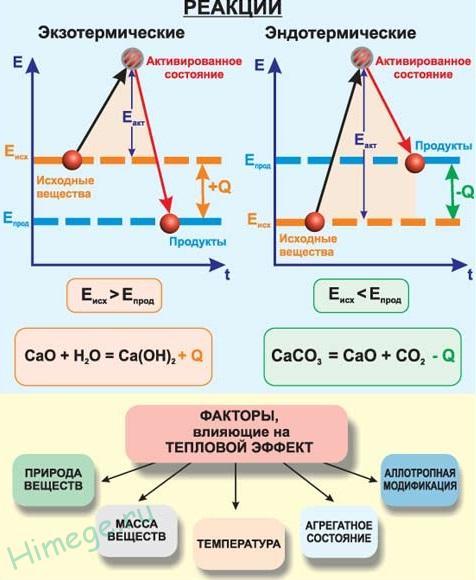
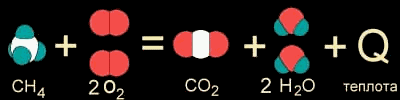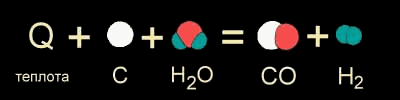Тепловой эффект реакции - количество теплоты, которое выделяется или поглощается в результате протекания химической реакции.
В каждом веществе запасено определенное количество энергии. С этим свойством веществ мы сталкиваемся уже за завтраком, обедом или ужином, так как продукты питания позволяют нашему организму использовать энергию самых разнообразных химических соединений, содержащихся в пище. В организме эта энергия преобразуется в движение, работу, идет на поддержание постоянной (и довольно высокой!) температуры тела.
Энергия химических соединений сосредоточена главным образом в химических связях. Чтобы разрушить связь между двумя атомами, требуется затратить энергию. Когда химическая связь образуется, энергия выделяется.
Атомы не соединялись бы между собой, если бы это не вело к "выигрышу" (то есть высвобождению) энергии. Этот выигрыш может быть большим или малым, но он обязательно есть при образовании молекул из атомов.
Любая химическая реакция заключается в разрыве одних химических связей и образовании других.
Когда в результате химической реакции при образовании новых связей выделяется энергии больше, чем потребовалось для разрушения "старых" связей в исходных веществах, то избыток энергии высвобождается в виде тепла. Примером могут служить реакции горения. Например, природный газ (метан CH4) сгорает в кислороде воздуха с выделением большого количества теплоты.
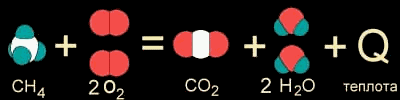
Реакция даже может идти со взрывом - так много энергии заключено в этом превращении. Такие реакции называются экзотермическими от латинского "экзо" - наружу (имея в виду выделяющуюся энергию).
В других случаях на разрушение связей в исходных веществах требуется энергии больше, чем может выделиться при образовании новых связей. Такие реакции происходят только при подводе энергии извне и называются эндотермическими (от латинского "эндо" - внутрь). Примером является образование оксида углерода (II) CO и водорода H2 из угля и воды, которое происходит только при нагревании.
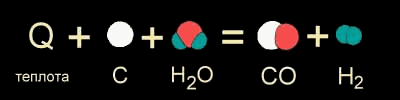
Изображение химических реакций при помощи моделей молекул: а) экзотермическая реакция, б) эндотермическая реакция. Модели наглядно показывают, как при неизменном числе атомов между ними разрушаются старые и возникают новые химические связи.
Таким образом, любая химическая реакция сопровождается выделением или поглощением энергии. Чаще всего энергия выделяется или поглощается в виде теплоты (реже - в виде световой или механической энергии). Эту теплоту можно измерить. Результат измерения выражают в килоджоулях (кДж) для одного моля реагента или (реже) для моля продукта реакции. Такая величина называется тепловым эффектом реакции. Например, тепловой эффект реакции сгорания водорода в кислороде можно выразить любым из двух уравнений:
2 H2(г) + O2(г) = 2 H2О(ж) + 572 кДж
или
H2(г) + 1/2 O2(г) = H2О(ж) + 286 кДж
Оба уравнения одинаково правильны и оба выражают тепловой эффект экзотермической реакции образования воды из водорода и кислорода. Первое - на 1 моль использованного кислорода, а второе - на 1 моль сгоревшего водорода или на 1 моль образовавшейся воды.
Значки (г), (ж) обозначают газообразное и жидкое состояние веществ. Встречаются также обозначения (тв) или (к) - твердое, кристаллическое вещество, (водн) - растворенное в воде вещество и т.д.
Обозначение агрегатного состояния вещества имеет важное значение. Например, в реакции сгорания водорода первоначально образуется вода в виде пара (газообразное состояние), при конденсации которого может выделиться еще некоторое количество энергии. Следовательно, для образования воды в виде жидкости измеренный тепловой эффект реакции будет несколько больше, чем для образования только пара, поскольку при конденсации пара выделится еще порция теплоты.
Используется также частный случай теплового эффекта реакции – теплота сгорания. Из самого названия видно, что теплота сгорания служит для характеристики вещества, применяемого в качестве топлива. Теплоту сгорания относят к 1 молю вещества, являющегося топливом (восстановителем в реакции окисления), например:
C2H2+2,5 O2 =2CO2 + H2O + 1300 кДж
Ацетилен теплота сгорания ацетилена
Существует два важнейших закона термохимии. Первый из них, закон Лавуазье–Лапласа, формулируется следующим образом:
Тепловой эффект прямой реакции всегда равен тепловому эффекту обратной реакции с противоположным знаком.
Это означает, что при образовании любого соединения выделяется (поглощается) столько же энергии, сколько поглощается (выделяется) при его распаде на исходные вещества. Например:
2H2(г) + O2(г) = 2H2О(ж) + 572 кДж (горение водорода в кислороде)
2 H2О(ж) + 572 кДж = 2H2(г) + O2(г) (разложение воды электрическим током)
Закон Лавуазье–Лапласа является следствием закона сохранения энергии.
Второй закон термохимии был сформулирован в 1840 г российским академиком Г. И. Гессом:
Тепловой эффект реакции зависит только от начального и конечного состояния веществ и не зависит от промежуточных стадий процесса.
Это означает, что общий тепловой эффект ряда последовательных реакций будет таким же, как и у любого другого ряда реакций, если в начале и в конце этих рядов одни и те же исходные и конечные вещества. Эти два основных закона термохимии придают термохимическим уравнениям некоторое сходство с математическими, когда в уравнениях реакций можно переносить члены из одной части в другую, почленно складывать, вычитать и сокращать формулы химических соединений. При этом необходимо учитывать коэффициенты в уравнениях реакций и не забывать о том, что складываемые, вычитаемые или сокращаемые моли вещества должны находиться в одинаковом агрегатном состоянии.