Классификация химических реакций в неорганической химии
Химические реакции классифицируют по различным признакам.
По числу исходных веществ и продуктов реакции
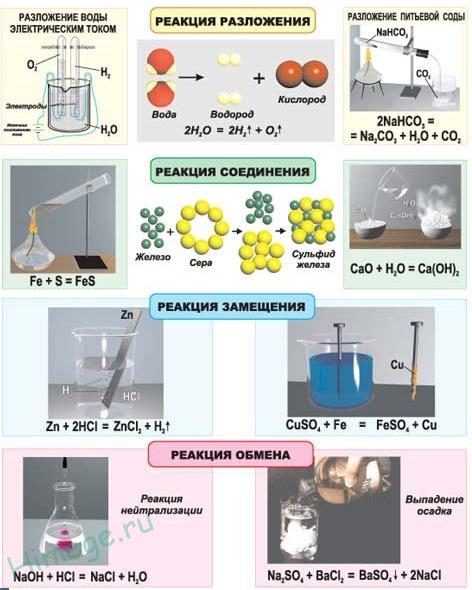
Разложение – реакция, в которой из одного сложного вещества образуются два и более простых или сложных веществ
2KMnO4 → K2MnO4 + MnO2 + O2
NH4NO2 → N2 + 2H2O
Cu(NO3)2 → CuO + 2NO2 + O2
Соединение – реакция, в результате которой из двух и более простых или сложных веществ, образуется одно более сложное
NH3 + HCl → NH4Cl
Mn2O7 + HOH → 2HMnO4
Замещение – реакция, протекающая между простыми и сложными веществами, при которой атомы простого вещества замещаются на атомы одного из элементов в сложном веществе.
SiO2 + F2 → SiF4 + O2
Fe + CuCl2 → Cu + FeCl2
Обмен – реакция, при которой два сложных вещества обмениваются своими составными частями
H2SO4 + Ba(NO3)2 → BaSO4 +2HNO3
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Одна из реакций обмена реакция нейтрализации – это реакция между кислотой и основанием, в результате которой получается соль и вода.
NaOH + HCl → NaCl + H2O
В органической химии выделяют дополнительно реакции присоединения, отщепления, изомерризации, полимеризации, поликонденсации и др.
По тепловому эффекту
Реакции, протекающие с выделением тепла, называются экзотермическими реакциями.
С + О2 → СО2 + Q
2. Реакции, протекающие с поглощением тепла, называются эндотермическими реакциями.
N2 + O2 → 2NO – Q
По признаку обратимости
Обратимые – реакции, проходящие при одних и тех условиях в двух взаимопротивоположных направлениях.
H2 + I2  2HI
2HI
Реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми, при этом должен выделяться газ, осадок, или малодиссоциирующее вещество- вода.
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Na2CO3 +2HCl → 2NaCl + CO2↑ + H2O
По изменению степени окисления веществ.
Окислительно-восстановительные реакции – реакции, протекающие с изменением степени окисления.
Са + 4HNO3 → Ca(NO3)2 + 2NO2 + 2H2O
2NaNO3 → 2NaNO2+ O2
И реакции, протекающие без изменения степени окисления.
HNO3 + KOH → KNO3 + H2O
CO2 + H2O → H2CO3
5. Классификация по агрегатному состоянию реагирующих веществ.
Гомогенные реакции, если исходные вещества и продукты реакции находятся в одном агрегатном состоянии (одной фазе). Такие реакции протекают во всем объёме реакционной среды. В качестве примеров можно рассмотреть реакции между газообразными веществами или ионами в водном растворе.
H2 (г) + F2 (г) → 2HF(г)
Гетерогенные реакции, если продукты реакции и исходные вещества находятся в разных агрегатных состояниях ( в разных фазах). Такие реакции протекают на поверхности раздела фаз. В качестве примера можно рассмотреть реакции с участием твердого вещества или твердых веществ, реакции между несмешивающимися жидкостями.
CaC2 + 2H2O → C2H2 + Ca(OH)2
6. По использованию катализатора.
Некаталитические реакции.
Такие реакции идут без участия катализатора:
2HgO → 2Hg + O2
Каталитические реакции.
Эти реакции происходят с участием катализатора:
2KClO3 → 2KCl + 3O2 в присутствии катализатора MnO2
4KClO3 →3KClO4 + KCl без катализатора.
Также выделяют классификации реакций по механизмам и протекания и по виду энергии, инициирующей реакцию.
Скорость химических реакций. Зависимость скорости химических реакций от концентрации, температуры и природы реагирующих веществ.
Химические реакции протекают с разными скоростями. Изучением скорости химической реакции, а также выявлением её зависимости от условий проведения процесса занимается наука - химическая кинетика.
скорость гомогенной реакции определяется изменением количества вещества в единице объёма:
υ =Δ n / Δt ∙V
где Δ n – изменение числа молей одного из веществ (чаще всего исходного, но может быть и продукта реакции), (моль);
Δt – интервал времени (с, мин);
V – объем газа или раствора (л)
Поскольку Δ n / V = ΔC (изменение концентрации), то
υ =Δ С / Δt ( моль/л∙ с)
скорость гетерогенной реакции определяется изменением количества вещества в единицу времени на единице поверхности соприкосновения веществ.
υ =Δ n / Δt ∙ S
где Δ n – изменение количества вещества (реагента или продукта), (моль);
Δt – интервал времени (с, мин);
S – площадь поверхности соприкосновения веществ (см2, м2)
Почему скорость разных реакций не одинакова?
Для того чтобы началась химическая реакция, молекулы реагирующих веществ должны столкнуться. Но не каждое их столкновение приводит к химической реакции. Для того чтобы столкновение привело к химической реакции, молекулы должны иметь достаточно высокую энергию. Частицы, способные при столкновении, вступать в химическую реакцию, называются активными. Они обладают избыточной энергией по сравнению со средней энергией большинства частиц – энергией активации Еакт. Активных частиц в веществе намного меньше, чем со средней энергией, поэтому для начала многих реакций системе необходимо сообщить некоторую энергию (вспышка света, нагревание, механический удар).
Энергетический барьер (величина Еакт) разных реакций различен, чем он ниже, тем легче и быстрее протекает реакция.
2. Факторы, влияющие на скорость реакции
(количество соударений частиц и их эффективность).
1) Природа реагирующих веществ: их состав, строение = энергия активации
▪ чем меньше Еакт, тем больше υ;
2) Температура:
при ↑ t на каждые 100 С, υ ↑ в 2-4 раза (правило Вант-Гоффа).
υ2 = υ1 ∙ γ Δt/10
3) Концентрация: чем больше, тем чаще происходят соударения и υ ↑. При постоянной температуре для реакции mA + nB = C по закону действующих масс:
υ = k ∙ СAm ∙ CBn
где k – константа скорости;
С – концентрация (моль/л)
Закон действующих масс:
Скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных их коэффициентам в уравнении реакции.
Для газообразных веществ скорость реакции зависит от давления
Чем больше давление, тем выше скорость.
4) Катализаторы –
вещества, которые изменяют механизм реакции, уменьшают
Еакт = υ ↑.
▪ Катализаторы остаются неизменными по окончании реакции
▪ Ферменты – биологические катализаторы, по природе белки.
▪ Ингибиторы – вещества, которые ↓ υ
Химическое равновесие. Факторы, влияющие на смещение равновесие. Принцип Ле-Шателье.
Химические реакции по направлению их протекания можно разделить
▪ Необратимые реакции
протекают только в одном направлении (реакции ионного обмена с ↑, ↓, мдс, горения и некоторые др.)
Например, AgNO3 + HCl → AgCl↓ + HNO3
▪ Обратимые реакции
при одних и тех же условиях протекают в противоположных направлениях (↔).
Например, N2 + 3H2 ↔ 2NH3
Состояние обратимой реакции, при котором
υ→ = υ← называется химическим равновесием.
Чтобы реакция на химических производствах проходила как можно полнее, необходимо сместить равновесие в сторону продукта. Для того, чтобы определить, как тот или иной фактор изменит равновесие в системе, используют принцип Ле Шателье (1844 г.):
Принцип Ле Шателье:
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие (изменить t, р, С), то равновесие сместится в ту сторону, которая ослабит это воздействие.
При увеличении температуры равновесие смещается в сторону эндотермической реакции.
при увеличении давления равновесие смещается в сторону реакции с меньшим количеством газообразных веществ.
при увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции.


