Электролиз.
Электролиз водных растворов и расплавов электролитов.
Любой атом-восстановитель, отдавая в ходе ОВР электроны, превращается в атом-окислитель, поскольку возможен обратный процесс:
-nē.
Восстановитель (1) → Окислитель (1)
+nē.
Восстановитель (1) ← Окислитель (1)
Аналогично, любой атом-окислитель, присоединяя электроны, превращается в атом-восстановитель:
+nē.
Окислитель (2) → Восстановитель (2)
-nē.
Окислитель (2) ← Восстановитель (2)
Таким образом, любая ОВР может быть представлена следующей схемой:
Восст-ль (1) + Ок-ль (2) → Ок-ль (1) + Восст-ль (2)
Слева направо ОВР может протекать самопроизвольно, если восстановитель (1) является более сильным, чем восстановитель (2), а окислитель (2) - более сильным, чем окислитель (1), т. е. более сильные окислитель и восстановитель взаимодействуют друг с другом с образованием менее сильных окислителя и восстановителя.
Например, самопроизвольно протекает реакция:
Fе + СuSО4 = FеSО4 + Сu
Fе0 + Сu2+ = Fe2+ + Сu0
(восст-ль) (ок-ль) (ок-ль) (восст-ль)
поскольку, согласно положению в электрохимическом ряду напряжений, Fе0- более активный восстановитель, чем Сu0, а Cu2+ - более активный окислитель, чем Fe2+. В обратном же направлении
(FеSО4 + Сu → Fе + СuSО4) реакция самопроизвольно не протекает.
Еще один пример. Самопроизвольно происходит реакция между металлическим натрием и хлором:
2 Na0 + С120 = 2 Na+1С1-1
так как Na0 - более активный восстановитель, чем Сl- , а атомы хлора, входящие в состав молекулы С12, - более активные окислители, чем ионы натрия Na+. Обратная реакция (т. е. распад NaС1 на Na и С12), как известно, самопроизвольно не протекает.
Значит ли это, что для рассмотренных и других ОВР протекание обратных реакций в принципе невозможно? Нет, невозможно лишь самопроизвольное протекание этих реакций.
Многие ОВР, не протекающие самопроизвольно, можно осуществлять путем электролиза, т. е. под действием энергии электрического тока.
Из теории электролитической диссоциации известно, что в водных растворах и в расплавах вещества-электролиты диссоциируют на ионы. Если в раствор или расплав электролита опустить электроды и подключить их к источнику постоянного тока, то хаотическое движение ионов сменяется направленным: положительно заряженные ионы (катионы) движутся к катоду, отрицательно заряженные ионы (анионы) - к аноду (рис. 4). Источник тока играет роль «электронного насоса», нагнетающего электроны на катод и удаляющего их с анода.
Рис.4. Схема электролизера
электроны→
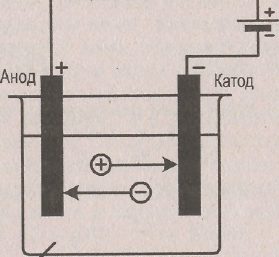
Поэтому на катоде катионы принимают электроны и восстанавливаются; на аноде анионы отдают электроны и окисляются. Таким образом, процессы окисления и восстановления оказываются пространственно разделенными: процесс окисления является анодным процессом, а процесс восстановления – катодным. В целом же, в процессе электролиза осуществляется та или иная окислительно-восстановительная реакция.
Процессы электролиза в расплавах и в водных растворах электролитов имеют существенные различия. В расплавах в окислительно-восстановительных процессах на электродах принимают участие только ионы электролита. В водных растворах в процессах на катоде и аноде, кроме ионов электролита, могут принимать участие и молекулы воды.
Электролиз расплавов электролитов.
В качестве примера рассмотрим электролиз расплава хлорида натрия. Под действием электрического тока имеющиеся в расплаве ионы Nа+ мигрируют к катоду, присоединяют электроны и восстанавливаются. Ионы Cl- мигрируют к аноду, где отдают свои электроны и окисляются. Данный процесс схематически отображен ниже:
t0
NаС1 ↔ Nа+ + С1-
↓ ↓
катод (- ) анод (+)
Na+ + 1ē→Na0 2С1- - 2ē→ Cl20↑
Суммарное уравнение реакции электролиза:
Nа+ + 1ē→Na0 │ 2
2Сl- - 2ē→Cl20 │ 1
2Na+ + 2Cl- = 2Nа 0+ Cl20
эл-з
2NaCl ==== 2Nа + Cl2↑
В результате процесса электролиза хлорид натрия разлагается на простые вещества - металлический натрий и газообразный хлор. Ни при каких других условиях, кроме электролиза, разложение хлорида натрия не происходит.
При электролизе расплавов солей на катоде всегда осуществляется процесс восстановления ионов металла, независимо от положения данного металла в электрохимическом ряду активности металлов.
Рассмотренный пример позволяет сформулировать общее определение электролиза:
• Электролизом называется окислительно-восстановительный процесс, протекающий на электродах при прохождении электрического тока через расплав или раствор электролита.
Сущность электролиза состоит в том, что за счет электрической энергии осуществляется химическая реакция, которая не может протекать самопроизвольно.
Электролиз водных растворов электролитов
Электролиз водных растворов электролитов представляет собой значительно более сложный процесс, так как кроме ионов самого электролита в окислительно-восстановительных процессах на электродах принимают участие молекулы воды.
В качестве примера рассмотрим процесс электролиза водного раствора хлорида натрия. В отличие от ранее рассмотренного электролиза расплава NаС1, в данном случае на катоде восстановление ионов Nа+ не происходит. Молекулы воды восстанавливаются легче, поэтому протекает следующий катодный процесс: 2Н2О + 2ē→ Н2 ↑ + 2ОН-
Полярные молекулы воды, находящиеся вблизи катода, ориентируются к нему положительными полюсами, на которых находятся ионы водорода Н+. Они принимают электроны и превращаются в атомы Н0, которые соединяются попарно, и в результате выделяется газообразный водород, а ионы ОН- остаются в растворе.
На аноде происходит окисление ионов Сl-, так как молекулы воды окисляются труднее. Анодный процесс протекает так же, как и в случае электролиза расплава хлорида натрия.
Схема электролиза:
на катоде : 2Н2О + 2ē → Н2 ↑ + 2ОН-
на аноде : 2С1- - 2ē → Cl20↑
________________________________
в ионном виде : : 2С1- + 2Н2О → Cl2↑ + Н2↑ + 2ОН-
в молекулярном виде :
эл-з
2NaCl + 2Н2О ==== Cl2↑ + Н2↑ + 2NaОН
При электролизе водных растворов различных солей окислительно-восстановительные процессы на катоде и аноде зависят от окислительной способности катионов металла и характера аниона соли. Для определения результатов электролиза водных растворов существуют следующие правила.
Процесс на катоде зависит от положения металла в электрохимическом ряду металлов.
1. Если катион электролита находится в начале ряда напряжений (по
А1 включительно), то на катоде идет процесс восстановления воды
(выделяется Н2↑). Катионы металла не восстанавливаются, остаются в
растворе.
Если катион электролита находится в ряду напряжений между
алюминием и водородом, то на катоде восстанавливаются одновременно
и ионы металла, и молекулы воды.
Если катион электролита находится в ряду напряжений после водорода, то на катоде идет только процесс восстановления ионов металла.
Если в растворе находится смесь катионов разных
металлов, то первыми восстанавливаются катионы металла, расположенного правее в электрохимическом ряду напряжений.
Рассмотренные правила сведены в табл.1.
Таблица 1.
Катодные процессы в водных растворах солей
| Электрохимический ряд напряжений металлов |
| Li, К, Са, Na, Мg, Аl | Мn, Zn, Fе, Ni, Рb
| Н2 | Cu, Hg, Ag, Pt, Au |
| Меn+ не восстанавлива- ются 2Н2О + 2ē = Н2 ↑ + 2ОН-
| Меn+ + nē = Ме0 2Н2О + 2ē = Н2 ↑ + 2ОН- Одновременно идут оба процесса |
| Меn+ + nē = Ме0 Молекулы воды не восстанавливаются |
Процесс на аноде зависит от природы аниона.
При электролизе растворов солей бескислородных кислот (кроме фторидов) на аноде идет процесс окисления аниона. Молекулы воды не принимают участия в анодном процессе.
При электролизе растворов солей, имеющих кислородсодержащие анионы (S042-, NO3-, РО43- и др.), а также фторидов (F-) на аноде идет процесс окисления воды:
2Н2О - 4ē = O2↑ + 4Н+.
Анионы солей в этом случае не принимают участия в анодном процессе.
По способности окисляться анионы располагаются в следующем порядке:
I-, Вr-, S2-, Сl-, ОН-, SО42-, NO3- , F-
(Н2O)
____________________________________
восстановительная активность уменьшается
Электролиз широко используют в промышленности для выделения и очистки металлов, получения щелочей, хлора, водорода.
Рассмотрим несколько типичных примеров электролиза.
Электролиз водного раствора нитрата меди (II)
p-p
Cu(NO3)2 ===== Cu2+ + 2NO3-
↓ ↓
Катод (-) Анод (+)
Cu2++2ē → Cu0│x 2 2Н2О - 4ē → O2↑ + 4Н+
(Cu стоит в ряду (NO3- - кислородсо-
напряжений после держащий анион,не
водорода) окисляется)
Суммарное ионное уравнение:
2Сu2+ + 2Н2О → О2↑ + 2Сu + 4Н+;
молекулярное уравнение:
эл-з
2Сu(NO3)2 + 2Н2О === О2↑ + 2Сu + 4НNO3
Электролиз водного раствора нитрата кальция
p-p
Cа(NO3)2 ===== Cа2+ + 2NO3-
↓ ↓
Катод (-) Анод (+)
2Н2О+2ē → Н2↑ + 2ОН- 2Н2О - 4ē → O2↑ + 4Н+
(восстановление ионов Cа2+ (окисление NO3- не происходит)
не происходит, так как Са
стоит в ряду напряжений
левее алюминия)
2Н2О+ 2ē → Н2↑ +ОН- │2
2Н2О - 4ē → O2↑ + 4Н+ │1
_______________________
4Н2О + 2Н2О → 2Н2↑ + O2↑ + 4Н2О
эл-з
2Н2О === 2Н2↑ + O2↑
Таким образом, молекулы соли вообще не принимают участия в процессе электролиза; в сущности , в данном случае происходит электролиз воды. Соль добавляется для повышения электропроводности воды.
Электролиз водного раствора гидроксида натрия
p-p
NаOН ===== Na+ + OH-
↓ ↓
Катод (-) Анод (+)
2Н2О+2ē → Н2↑+2ОН-│x2 4ОН- - 4ē → O2↑ + 2Н2О
Суммарное ионное уравнение:
4Н2О + 4ОН- = 2Н2 ↑ + О2↑ + 4OН- + 2Н2О
2Н2О = 2Н2↑ + O2↑
Таким образом, и в этом случае происходит электролиз воды.
Электролиз с растворимым анодом
Выше были рассмотрены примеры электролиза с так называемыми инертными электродами, т. е. электродами, материал которых не участвует в электродных процессах. Инертные (нерастворимые) электроды изготовляют из угля, графита, платины и других благородных металлов.
Особым случаем электролиза является электролиз с растворимым анодом. Растворимые аноды изготовляют из меди, серебра, цинка, никеля, железа и других металлов.
Растворимый анод при электролизе подвергается окислению:
Ме0 - nē → Ме n+
Образующиеся ионы металла переходят в раствор. Этот процесс требует меньших затрат энергии, чем процесс окисления любых анионов или молекул воды. Поэтому именно этот процесс является основным анодным процессом.
Перешедшие в раствор катионы металла Ме n+ перемещаются к катоду и могут принять участие в катодном процессе.
Примером электролиза с растворимым анодом может служить электролиз раствора СuSО4 с медными электродами. На аноде происходит процесс окисления меди:
Сu0 - 2ē = Сu2+
Этот процесс происходит легче, чем окисление ионов SО42- или молекул воды. Перешедшие в раствор ионы меди перемещаются к катоду, на котором происходит процесс их восстановления:
Сu2+ + 2ē = Сu 0
Таким образом, электролиз сводится к переносу меди с анода на катод. Электролиз раствора медного купороса с анодом из меди используют для ее электрохимической очистки (рафинирования). В этом случае катоды изготавливают из рафинированной меди, а анодами является черновая медь, содержащая примеси (рис.5). B процессе электролиза медный анод растворяется, и содержащиеся в нем примеси окисляются и переходят в раствор или выпадают на дно электролизера в виде осадка, а чистая медь осаждается на катоде.
|
e↑ |
|
e↓ |
|
|
↑e |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| Cu (черновая) Анод |
---- Сu2+ | Cu (рафин.)
|
Сu2+ | Cu (черновая) Анод |
|
|
|
|
| Раствор СuSO4 + Н2SO4 |
|
|
|
Рис.5. Электрохимическое рафинирование меди
Первый закон Фарадея
Масса вещества, образующегося на электроде, пропорциональна количеству пропущенного электричества.
Количественной мерой электрического заряда является F (фарадей).
Фарадей – заряд, который несет на себе один моль электронов или один моль однозарядных ионов
1F = 96500 Кл/моль = заряд 1 моля электронов
Пример. Электролиз AgNO3
Ag+ + 1ē = Ag0
1моль 1моль 1моль
Электрический заряд в один фарадей разряжает один моль ионов серебра , в результате чего образуется 1 моль Ag.
Это значит, что при пропускании тока в 2 F вызовет образование 2 моль Ag.
Второй закон Фарадея
Для разряда одного моля какого-либо иона на электроде необходимо пропустить через электролит такое число фарадеев заряда, которое равно числу зарядов на этом ионе.
Применение электролиза
Электролиз в металлургии:
а) Из растворов солей получают Cu, Zn, Cd, Ni, Co, Mn.
б) Рафинирование :Cu, Au, Ag, Sn.
Анодом при рафинировании служит отрицательный металл.
На аноде растворяется основной металл и примеси, имеющие более отрицательный Е0.
Примеси, имеющие более положительные значения, выпадают в осадок в виде шлака.
Рафинирование черного никеля, содержащего медь, цинк – примеси.
Получают на катоде – чистый никель, в осадке – медь и в растворе –цинк.
в) Электролизом расплава получают Al, Mg, Ca, Be.


