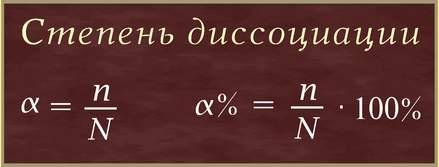Электролиты и неэлектролиты
Одним из признаков классификации веществ может служить способность вещества растворяться или не растворяться в растворителе. Учёные утверждают, что практически нерастворимых веществ в воде не существует. Истинные растворы бывают молекулярными, ионно-молекулярными и ионными. Некоторые вещества под действием растворителя переходят в раствор в виде молекул, сохраняя молекулярную структуру. При этом в растворе присутствуют молекулы растворённого вещества и частицы растворителя. Такие вещества называются неэлектролитами. В растворе каждая молекула вещества окружена молекулами растворителя, образуя сольватную оболочку (в случае воды – гидратную). Примерами неэлектролитов являются многие органические вещества: сахара, формальдегид, мочевина. Процесс сольватации экзотермичен, выделяющаяся энергия расходуется на преодоление сил межмолекулярного притяжения растворённого вещества. В XIX веке были обнаружены закономерности замерзания и кипения растворов неэлектролитов: замерзают при более низких температурах, и кипят при более высоких температурах по сравнению с чистым растворителем. Отклонения температуры прямо пропорциональны концентрации неэлектролита. В это же время М. Фарадей обнаружил растворы, которые проводят электрический ток. Он назвал их электролитами и высчитал, что они имеют более низкие температуры кристаллизации и более высокие температуры кипения и по сравнению с чистым растворителем и по сравнению с растворами неэлектролитов. Растворы электролитов ведут себя так, будто частиц в единице объёма больше, чем для раствора неэлектролита. Шведский химик С.Аррениус в 1887 году пребположил, что вещества-электролиты в водном растворе распадаются не до молекул, а до более мелких частиц. Сейчас мы знаем, что эти заряженные частицы называются ионами, а процесс распада вещества при растворении или расплавлении называется электролитической диссоциацией. Русские химики Каблуков И.А. и Кистяковский В.А. применили к объяснению процесса электролитической диссоциации химическую теорию растворов Менделеева Д.И.. 
Вещества-электролиты предрасположены к диссоциации: это вещества с ковалентной полярной или ионной связью, а значит, в них есть смещение электронной плотности от одного атома к другому, что облегчает гидратацию частиц, повышает экзотермичность процесса. Диссоциация – обратимый процесс, обратный называется ассоциацией.
Особую группу соединений составляют малорастворимые электролиты. 
Опыт:
В ступке измельчаем школьный мел. Размешиваем его в пробирке с водой. Наблюдаем образование грубодисперстной системы – взвеси.
После отстаивания частиц карбоната кальция мутная жидкость становится прозрачной. Мы говорим о нерастворимости соли в воде.
Каплю жидкости помещаем на предметное стекло и выпариваем. Наблюдаем белый налёт. Это незначительное количество карбоната кальция, которое все-таки растворилось (растворимость СаСО3 составляет 6 мг в 100г воды)
Вывод: то небольшое количество соли, которое растворилось в воде, полностью продиссоциировало. СаСО3 – малорастворимый электролит. Концентрации ионов малорастворимых электролитов в насыщенных растворах ничтожно малы, ими можно пренебречь.
СаСО3 + 2Н+ = Са+2 + СО2 + Н2О
Сильные и слабые электролиты. Степень электролитической диссоциации
С. Аррениус ввёл понятие «степень электролитической диссоциации» для количественной оценки способности электролита распадаться на ионы.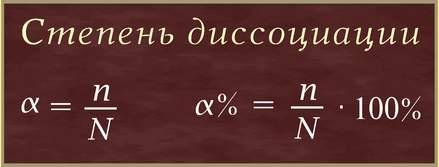
Степень электролитической диссоциации (α) – это соотношение числа моль электролита, распавшегося на ионы, к общему числу моль электролита в растворе. Выражается в долях единицы или в процентах. Физический смысл этой величины – доля электролита, распавшегося на ионы. В зависимости от величины степени диссоциации С Аррениус разделил все электролиты на сильные и слабые.
| Сильные, α стремится к 1 | Слабые, α значительно меньше 1 |
| Почти все соли, в том числе и органических кислот | Органические кислоты НСООН, С6Н5СООН |
| Некоторые неорганические кислоты: HNO3, HCl, HBr, HI, HClO4, HМnO4, H2SO4 | Многие неорганические кислоты: H2S, H2CO3, HNO2, HCN, H3BO3,HСlO, HСlO2 |
| Щёлочи: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2, Tl(OH)2 | Гидрат аммиака NH3 х H2O |
| Вода |
Степень электролитической диссоциации зависит от:
природы электролита и растворителя. Чем полярнее растворитель, тем выше степень диссоциации растворённого вещества. Так, уксусная кислота (слабый электролит) в воде диссоциирует сильнее, чем в этиловом спирте. Концентрация кислоты в обоих растворителях одинакова.
температуры. Процесс электролитической диссоциации – эндотермический процесс, в соответствии с правилом Ле Шателье при увеличении теппературы равновесие смещается вправо, степень диссоциации при нагревании увеличивается.
от концентрации электролита в растворе. Разбавление раствора всегда усиливает диссоциацию вещества.
3.Реакции ионного обмена.
Реакции между растворами электролитов являются реакциями между ионами, образовавшимися в результате электролитической диссоциации исходных веществ. Поскольку взаимодействие осуществляется между ионами, несущими противоположные заряды, скорость таких процессов очень велика, реакции протекают практически мгновенно. Пример: выпадение осадка AgCl происходит сразу же после добавления раствора хлорида натрия к раствору нитрата серебра.
Уравнения таких реакций записывают в молекулярном и ионном виде. Уравнения реакций между растворами электролитов, в которых фигурируют ионы, на которые диссоциируют электролиты, называются ионными или ионно-молекулярными.
Для написания ионных уравнений реакций существуют определенные правила:
В ионных уравнениях для сильных электролитов следует писать формулы ионов, на которые диссоциируют электролиты.
Для слабых электролитов и нерастворимых соединений в ионных уравнениях пишутся химические формулы веществ в недиссоциированном виде.
То есть в ионных уравнениях формулы сильных электролитов пишутся в диссоциированном виде; слабых – в недиссоциированном.
Если в ионном уравнении фигурируют все ионы, образованные в результате диссоциации реагирующих электролитов, такое уравнение называется полным ионным уравнением.
Если в ионном уравнении фигурируют только ионы, непосредственно участвующие в реакции, такое уравнение называется сокращенным ионным уравнением.
Сокращенное ионное уравнение получается из полного путем сокращения одинаковых ионов в правой и левой части уравнения, подобно процедуре упрощения математического уравнения. Сокращенное ионное уравнение компактнее полного, оно наиболее наглядно отражает сущность протекающей реакции.
Примеры:
1. NaСl + AgNO3 = AgCl + NaNO3 – молекулярное уравнение;
Na+ + Сl– + Ag+ + NO3– = AgCl + Na+ + NO3– – полное ионное уравнение;
Ag+ + Сl– = AgCl – сокращенное ионное уравнение.
2. К2СО3 + 2HCl = 2KCl + CO2+ H2O – молекулярное уравнение;
2H+ + CO32– = CO2+ H2O – сокращенное ионное уравнение.
Условия протекания реакций ионного обмена.
Для реакций ионного обмена справедливы общие закономерности протекания химических реакций.
Диссоциация – процесс обратимый, одновременно с ней протекает и обратный процесс – ассоциация, то есть, в растворе электролита существует динамическое равновесие между недиссоциированной формой электролита и продуктами его электролитической диссоциации (ионами). Положение равновесия определяется, в основном, природой электролита. Для сильных электролитов равновесие процесса электролитической диссоциации сильно смещено в сторону образования ионов (вправо), то есть, в растворе практически отсутствует недиссоциированная форма электролита, поэтому считается, что сильные электролиты диссоциируют полностью и необратимо. В растворах слабых электролитов равновесие диссоциации смещено влево, в растворе преобладает недиссоциированная форма электролита, ионы присутствуют в незначительных количествах.
Изменяя условия протекания реакции, можно смещать положение равновесия вправо (в сторону образования продуктов реакции), или влево (в сторону образования исходных веществ).
В соответствии с общими принципами протекания обратимых химических реакций, равновесие реакции смещается вправо при выводе продуктов из зоны реакции. Для реакций ионного обмена этот принцип реализуется в случае образования нерастворимых и газообразных продуктов.
Примеры:
Образование нерастворимого продукта (выпадение осадка):
Ba(NO3)2 + Na2SO4 = BaSO4 + 2NaNO3
Ba2+ + 2NO3– + 2Na+ + SO42– = BaSO4 + 2Na+ + 2NO3–
Ba2+ + SO42– = BaSO4 .
Образование газообразного продукта:
Na2S + 2HCl = 2NaCl + H2S
2Na+ + S2– + 2H+ + 2Cl- = 2Na+ + 2Cl– + H2S
S2– + 2H+ = H2S.
В случае образования слабого электролита, равновесие его ассоциации (процесс, обратный диссоциации) смещено вправо, тем самым смещается вправо равновесие данной реакции ионного обмена.
Пример. Реакция нейтрализации
NaOH + HCl = NaCl + H2O
Na+ + OH– + H+ + Cl– = Na+ + Cl– + H2O
H+ + OH– = H2O.
Можно заключить, что условиями необратимого протекания реакций ионного обмена являются:

Образование нерастворимого соединения (выпадение осадка).
Образование газообразного продукта (выделение газа).
Образование слабого электролита (в частности, воды).